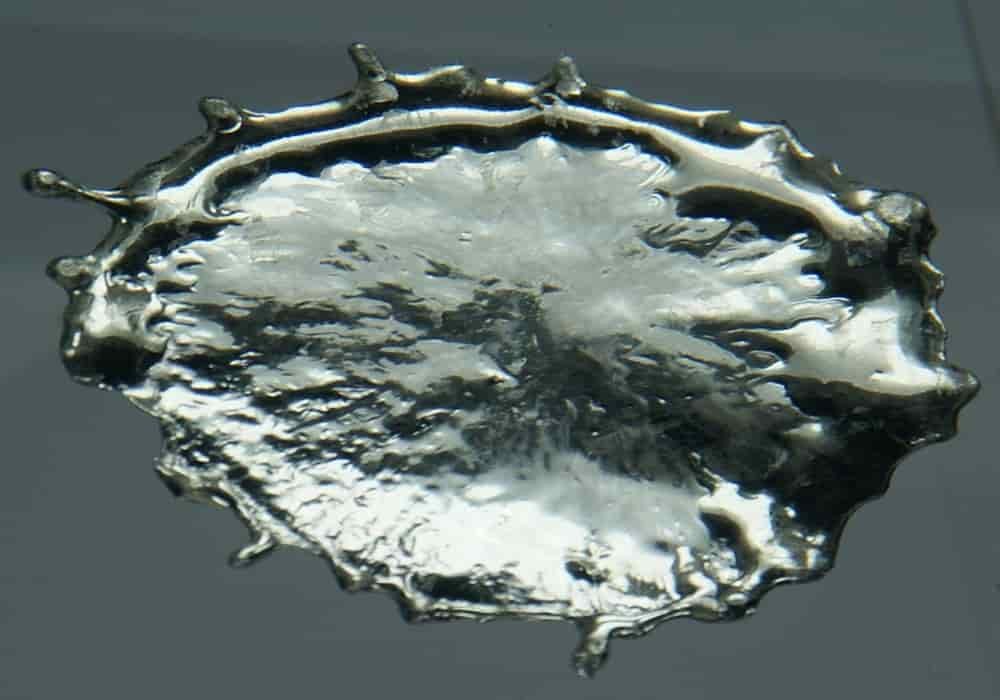
Timah
Timah adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Sn dan nomor atom 50.
Unsur ini merupakan logam miskin (logam post-transisi) keperakan, dapat ditempa (malleable), tidak mudah teroksidasi dalam udara sehingga tahan karat, ditemukan dalam banyak aloy, dan digunakan untuk melapisi logam lainnya untuk mencegah karat. Timah diperoleh terutama dari mineral kasiterit yang terbentuk sebagai oksida.
Jumlah kecil timah dalam makanan kaleng tidak berbahaya bagi manusia. Senyawa timah trialkil dan triaril berbahaya bagi makhluk hidup dan harus ditangani secara hati-hati. Timah juga digunakan dalam pembuatan grenjeng rokok (timah putih), pada longsongan peluru (timah hitam / timbal).
Fisik Timah
Timah merupakan logam perak keputih-putihan. Dalam keadaan normal (13 – 160 °C), logam ini bersifat mengkilap dan mudah dibentuk.
Timah juga tidak mudah teroksidasi dalam udara sehingga tahan karat. Ditemukan dalam banyak alloy, dan digunakan untuk melapisi logam lainnya untuk mencegah karat.
Kegunaan Timah
Bahan solder
Di negara-negara maju seperti Amerika serikat dan Inggris timah banyak digunakan sebagai baham memproduksi Solder. Solder adalah paduan timah dengan timbal yang memiliki titik didih rendah.
Biasanya solder digunakan untuk menggabungkan dua logam. Sobat pasti akrab dengan kabel loga yang melekat pada perangkat listrik yang biasanya direkatkan dengan menggunakan solder. Solder juga digunakan oleh tukang pipa untu menyambungkan dua buah pipa yang terbuat dari logam.
Pembuatan timah foil / Kertas timah
Timah foil mirip seperti alumunium foil, ia digunakan untuk membungkus makanan sepereti permen, tembakau, atau produk lainnya. Timah akan melindungi produk yang dibukusnya dari kontak langsung dengan udara. Akan tetapi karena harganya yang lebih mahal maka penggunaannya tidak begitu banyak. Banyak orang lebih memilih menggunakan alumunium foil yang harganya lebih murah.
Paduan untuk perunggu
Timah juga digunakan dalam pembuatan paduan perunggu. Perunggu adalah paduan yang terbuat dari timah dan tembaga (cuprum). Perunggu banyak digunakan di kehidupan kita, selain untuk bahan medali perunggu juga banyak digunakan dalam industri pembuatan kawat, alat-alat listrik, alat pengukur air dan juga industri pembuatan katub perunggu.
Melapisi logam (Tin Plating)
Tin Plating adalah proses melapisi permukaan sebuah logam dengan menggunakan tima cair. Karena sifatnya yang tahan terhadap korosi oleh udara , asam, basa, dan air, maka akan membuat logam yang dilapisinya lebih awet. Contoh dari tin plating adalah pada kaleng makanan dan minuman seperti kaleng susu. Kaleng makanan atau minuman biasanya dibuat dari besi atau baja yang dilapisi dengan timah. Akan tetapi karena harganya lebih mahal, kaleng makanan sekarang kebanyakan dibuat dari logam alumunium yang harganya lebih murah.

Sifat Fisik Timah (Sn)
- Keadaan benda : Padat
- Titik lebur : 505.08 K (449.47 °F)
- Titik didih : 2875 K (4716 °F)
- Densitas : 7,365 g/cm3 (Sn putih) 5,769 g/cm3 (Sn abu-abu)
- Volume molar : 16.29 ×10-6 m3/mol
- Kalor penguapan : 295.8 kJ/mol
- Kalor peleburan : 7.029 kJ/mol
- Kalor jenis : 27,112 J/molK
- Panas fusi : 7,03 kJ/mol
- Kecepatan suara : 2500 m/s pada 293.15 K
Sifat Kimia Timah (Sn)
- Bobot atom : 118.710 sma
- Berat jenis : 7,3 g/cm3
- Jari-jari atom : 145 pm
- Konfigurasi electron : [Kr]4d10 5s2 5p2
- Bilangan oksidasi : 4, 2, – 4
- Nomor atom : 50
- Nomor massa : 118,71
- Elektronegatifitas : 1,96 (skala pauli)
- Jari-jari atom : 140 pm
- Struktur Kristal : tetragonal (Sn putih) kubik diamond (Sn abu-abu)
- Konduktifitas termal : 66,8 W/mK
- Jika timah dipanaskan dengan adanya udara maka akan terbentuk SnO2.
- Timah larut dalam HCl, HNO3, H2SO4, dan beberapa pelarut organik seperti asam asetat asam oksalat dan asam sitrat. Timah juga larut dalam basa kuat seperti NaOH dan KOH.
- Timah bereaksi dengan klorin secara langsung membentuk Sn(IV) klorida.
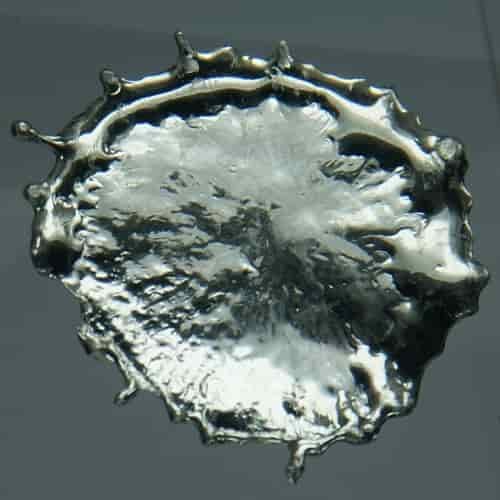
Senyawa Timah
Timah dalam bentuk senyawaannya memiliki tingkat oksidasi +2 dan +4, tingkat oksidasi +4 lebih stabil dari pada +2. Pada tingkat oksidasi +4, timah menggunakan seluruh elektron valensinya, yaitu 5s2 5p2 dalam ikatan, sedangkan pada tingkat oksidasi +2, timah hanya menggunakan elektron valensi 5p2 saja.
Akan tetapi jika timah dalam bentuk kompleksnya, seperti organotimah, ternyata timah menjadi bermanfaat, karena diketahui organotimah, khususnya organotimah(IV) mempunyai berbagai macam aktivitas biologis, seperti antimikroba.
Timah Oksida
Merupakan senyawa anorganik dengan rumus kimia SnO2. Oksida timah ini merupakan oksida timah yang paling penting dalam pebuatan logam timah. SnO2 memiliki struktur kristal rutile dimana setiap 1 atom Sn berkoordinasi dengan 6 atom oksigen. SnO2 tidak larut dalam air akan tetapi larut dalam asam dan basa kuat. SnO2 larut dalam asam halide membentuk heksahalostanat seperti:
SnO2 + 6HI -> H2SnI6 + 2 H2O
Atau jika dilarutkan dalam asam maka:
SnO2 + 6 H2SO4 -> Sn(SO4)2 + 2 H2O
SnO2 larut dalam basa membentuk stanat dengan rumus umum Na2SnO3. SnO2 digunakan bersama dengan vanadium oksida sebagai katalis untuk oksidasi senyawa aromatic, dipakai sebagai pelapis, ataupun sebagai bahan pembuatan organotin.
Timah(II) Klorida
SnCl2 berupa padatan kristal berwarna putih, dapat membentuk dihidrat yang stabil. SnCl2 dipakai sebagai reduktor dalam larutan asam, dan juga dalam cairan electroplating. SnCl2 dibuat dengan cara reaksi gas HCl kering dengan logam Sn.
Sn + 2HCl -> SnCl2 + H2
SnCl2 memiliki satu pasangan electron bebas. Dalam bentuk fasa gas maka molekul SnCl2 berbentuk bengkok, sedangkan pada bentuk padatan SnCl2 membentuk rantai yang saling terhubung dengan jembatan klorida. Selain dipakai sebagai reduktor SnCl2 juga dipakai sebagai katalis, reagen analisis untuk raksa, dan juga dipakai sebagai aditif makanan untuk mempertahankan warna dan sebagai antioksidan.
Timah(IV) Klorida
Disebut juga stani klorida atau timah tetraklorida merupakan senyawaan kimia dengan rumus SnCl4. Pada suhu kamar SnCl4 ini merupakan cairan yang tidak berwarna dan akan membentuk kabut jika terjadi kontak dengan udara. SnCl4 dipergunakan sebagai senjata kimia dalam perang dunia ke-1, dipakai untuk memperkuat gelas, dan sebagai bahan dasar pembuatan organotin.
Timah Sulfida
Senyawaan timah dengan belerang terdapat sebagai SnS yaitu timah(II)sulfide dan ada dialam sebagai mineral herzenbergite. Pebuatan SnS adalah dibuat dengan mereaksikan belerang, SnCl2 dan H2S.
Sn + S -> SnS
SnCl2 + H2S -> SnS + 2HCl
Sedangkan timah(IV) sulfide memiliki rumus SnS2 dan terdapat dialam sebagai mineral berndtite. Senyawa ini mengendap sebagai padatan berwarna coklat dengan penambahan H2S pada larutan senyawa timah(IV) dan banyak dipakai sebagai ornament dekoratif karena warnanya mirip emas.
Timah Hidrida
Hidrida dari timah disebut sebagai stannan dan rumus formulanya adalah SnH4. Hidrida timah ini dapat dibuat dengan cara mereaksikan antara SnCl4 dengan LiAlH4. Stannan terdekomposisi secara lambat menghasilkan loga timah dan gas hydrogen. Hidrida timah ini sangat analog dengan gas metana CH4.
Stanat
Dalam ilmu kimia stanat berkoporasi dengan senyawaan:
Ortostanat yang memiliki rumus kimia SnO44- contoh senyawaannya adalah K4SnO4 atau Mg2SnO4.
Metastanat yaitu MSnO3 atau M2SnO3 yaitu campuran oksida atau polimerik anoin.
Perlu dicatat bahwa asam stanit yang merupakan precursor stanat sebenarnya tidak terdapat dialam dan ini sebenarnya merupakan hidrat dari SnO2. Istilah stanat juga dipakai untuk sufiks penamaan senyawa misalnya SnCl62- hesaklorostanat.

Isotop Timah
Seperti yang telah disebutkan diatas bahwa timah memiliki nomor atom 50 dan nomor massa rata-rata adalah 118,71. Dengan nomor atom tersebut maka timah memiliki konfigurasi electron [Kr] 5s2 4d10 5p2.
Dalam sistem tabel periodic timah berada pada golongan utama IVA (atau golongan 14 untuk sistem periodic modern) dan periode 5 bersama dengan C, Si, Ge, dan Pb. Timah menunjukkan kesamaan sifat kimia dengan Ge dan Pb seperti pembentukan keadaan oksidasi +2 dan +4.
Timah memiliki tiga bentuk alotrop, yaitu timah abu-abu (α), timah putih (β), dan timah rombik (γ). Pada suhu ruang, timah lebih stabil sebagai logam timah putih (-Sn) dalam bentuk tetragonal. Sedangkan pada suhu rendah, timah putih berubah menjadi timah abu-abu (-Sn) berbentuk intan kubik berupa nonlogam. Perubahan 5 ini terjadi cepat karena timah membentuk oksida film. Peristiwa ini dikenal sebagai plak timah atau timah plague.
Isotop Timah terstabil
| Isotop | Kelimpahan | Waktu paruh(t1/2) | Moda peluruhan | Produk | |
|---|---|---|---|---|---|
| 112Sn | 0.97% | 112Sn stabil dengan 62 neutron | |||
| 114Sn | 0.66% | 114Sn stabil dengan 64 neutron | |||
| 115Sn | 0.34% | 115Sn stabil dengan 65 neutron | |||
| 116Sn | 14.54% | 116Sn stabil dengan 66 neutron | |||
| 117Sn | 7.68% | 117Sn stabil dengan 67 neutron | |||
| 118Sn | 24.22% | 118Sn stabil dengan 68 neutron | |||
| 119Sn | 8.59% | 119Sn stabil dengan 69 neutron | |||
| 120Sn | 32.58% | 120Sn stabil dengan 70 neutron | |||
| 122Sn | 4.63% | 122Sn stabil dengan 72 neutron | |||
| 124Sn | 5.79% | 124Sn stabil dengan 74 neutron | |||
| 126Sn | sisa | 2.3×105thn | β− | 126Sb | |
Sejarah Timah
Timah telah diketahui dan dimanfaatkan manusia selam ribuan tahun. Ia telah ditemukan oleh manusia sejak sebelum masehi. Dalam kita suci orang hindu, Reg Veda yang ditulis sekitar 1000 tahun sebelum masehi telah menyebutkan adanya beberapa logam termasuk timah.
Tahap Proses Pemurnian Refinery Pengolahan Bijih Timah
Karakterisasi Bijih Timah
Bijih timah yang ditambang di Indonesia umumnya adalah dari jenis endapan timah aluvial dan sering disebut sebagai endapan timah sekunder atau disebut timah placer. Jenis bijih timah ini sudah terlepas dari endapan induknya yaitu timah primer, dan oleh air diendapkan kembali di tempat lain yang lebih rendah.
Secara ekonomis, mineral penghasil timah putih adalah kasiterit dengan rumus kimia SnO2, walaupun ada sebagian kecil timah yang dihasilkan dari sulfida seperti stanit, silindrit, frankeit, kanfieldit dan tealit. Mineral utama yang terkandung di dalam bijih timah adalah kasiterit, sedangkan mineral ikutannya adalah pirit, kuarsa, zirkon, ilmenit, galena, bismut, arsenik, stibnit, kalkopirit, xenotim, dan monasit.
Pengolahan Bijih Timah
Secara garis besar, pengolahan bijih timah menjadi logam timah terdiri dari operasi konsentrasi/mineral dressing, dan ekstraksi yaitu peleburan atau smelting dan pemurnian atau refining.
Tahap Konsentrasi
Tahap Smelting
Proses smelting merupakan proses reduksi dari konsentrat bijih timah pada temparatur tinggi menjadi logam timah. Prinsip reduksi adalah melepas ikatan oksigen yang terdapat mineral kasiterit. Reduktor yang digunakan sebagai pereduksi adalah gas CO. Reaksi yang terjadi selama proses smelting adalah:
SnO2 + CO = SnO + CO2
SnO + CO = Sn + CO2
Pada proses smelting akan terbentuk lelehan terak dan timah yang tidak saling larut. Slag akan mengikat pengotor-pengotor yang terdapat di dalam konsentrat. Pengotor yang paling banyak terdapat di dalam konsentrat timah adalah unsur Fe.
Proses smelting ini terdiri dari dua tahapan. Peleburan tahap pertama adalah peleburan konsentrat timah yang menghasilkan timah kasar atau crude tin dan terak I (slag). Kadar timah dalam terak I ini adalah sekitar 20%. Tahap ini juga dikenal dengan sebutan peleburan konsentrat timah karena umpan yang dilebur adalah konsentrat bijih timah.
Terak I kemudian dilebur kembali di peleburan tahap kedua. Peleburan pada tahap dua ini menghasilkan senyawa Fe-Sn yang disebut hardhead dan terak II dengan kadar Sn kurang daripada 1%. Hardhead menjadi bahan baku untuk peleburan tahap satu.
Tahap Refining
Crude tin dari proses peleburan tahap satu kemudian dibawa ke proses selanjutnya yaitu proses pemurnian. Kandungan timah dalam crude tin adalah Sn >90% dan sisanya adalah pengotor seperti As, Pb, Ag, Fe, Cu, dan Sb.
Pemurnian timah dari pengotornya dapat dilakukan dengan kettle refining, eutectic refining, serta electrolytic refining. Pemilihan teknologi untuk proses pemurnian adalah berdasarkan tingkat kemurnian logam timah yang diinginkan. Setelah melewati tahap refining ini, kemurnian logam timah dapat mencapai 99,93%.
Tabel Periodik Kimia – Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna Dan Jenis
Tabel periodik adalah tampilan unsur-unsur kimia dalam bentuk tabel. Unsur-unsur tersebut disusun berdasarkan nomor atom (jumlah proton dalam inti atom), konfigurasi elektron dan keberulangan sifat kimia. Klik disini untuk membaca tabel periodik yang komplit.
Bacaan Lainnya
- Rumus Kimia Konsep Mol Dan Empiris Beserta Contoh Soal Dan Jawaban
- Manfaat Kalsium Untuk Tubuh Manusia
- Indonesia Juga Memiliki 3 Reaktor Nuklir
- Reaktor Nuklir Alami Zaman Purba
- Awalnya, reaktor nuklir pertama digunakan untuk produksi plutonium sebagai bahan senjata nuklir
- Top 10 Sungai Terpanjang Di Dunia
- Tes Kepribadian Warna & Warna Mana Yang Anda Miliki? Hijau, Oranye, Biru, Emas
- Kepalan Tangan Menandakan Karakter Anda & Kepalan nomer berapa yang Anda miliki?
- Tempat Wisata Yang Harus Dikunjungi Di Tokyo – Top 10 Obyek Wisata Yang Harus Anda Kunjungi
- Cara Membeli Tiket Pesawat Murah Secara Online Untuk Liburan Atau Bisnis
- Tibet Adalah Provinsi Cina – Sejarah Dan Budaya
- Puncak Gunung Tertinggi Di Dunia dimana?
- TOP 10 Gempa Bumi Terdahsyat Di Dunia
- Apakah Matahari Berputar Mengelilingi Pada Dirinya Sendiri?
- Test IPA: Planet Apa Yang Terdekat Dengan Matahari?
- 10 Cara Belajar Pintar, Efektif, Cepat Dan Mudah Di Ingat – Untuk Ulangan & Ujian Pasti Sukses!
- TOP 10 Virus Paling Mematikan Manusia
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan lebih sering terdengar jika Anda mengunduh aplikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Sumber bacaan: Wikipedia, Royal Society of Chemistry, Britannica
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya