Tabel Periodik: Pengertian, Penyusunan, dan Contoh
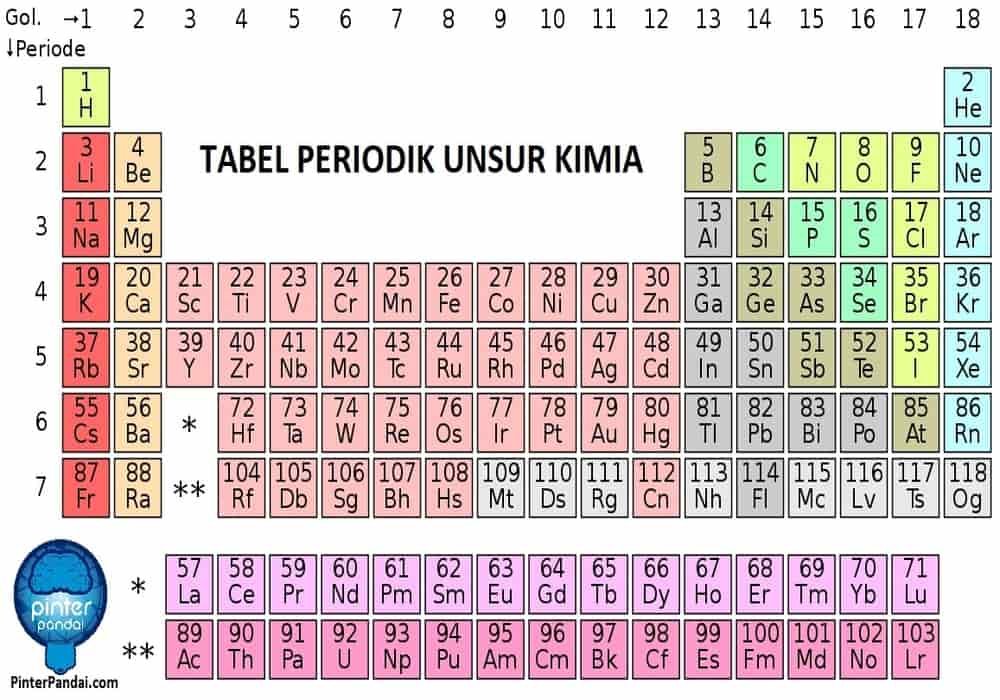
Tabel Periodik adalah susunan unsur-unsur kimia dalam bentuk tabel yang diatur berdasarkan nomor atom, konfigurasi elektron, dan sifat kimia yang berulang. Tabel ini menjadi fondasi ilmu kimia dan membantu memprediksi perilaku unsur-unsur, termasuk reaksi dan senyawa yang dapat mereka bentuk.
Penting: Jika Anda menggunakan smartphone, ubah tampilan menjadi horizontal (landscape) untuk melihat tabel periodik dengan lebih jelas.
1. Pengertian Tabel Periodik
- Definisi Singkat
- Tabel periodik memuat unsur-unsur mulai dari Hidrogen (H) dengan nomor atom 1 hingga unsur-unsur super berat (buatan). Setiap sel tabel memuat nama unsur, lambang, dan nomor atom.
- Sejarah
- Ditemukan konsepnya pertama kali oleh Dmitri Mendeleev (1869), lalu disempurnakan seiring ditemukannya unsur-unsur baru.
- Tujuan
- Menata unsur berdasarkan kemiripan valensi (konfigurasi elektron di kulit luar), golongan, dan periode. Unsur dalam satu golongan (kolom) memiliki sifat kimia mirip.
2. Penyusunan Tabel Periodik
- Nomor Atom:
- Menunjukkan jumlah proton di dalam inti atom. Peningkatan nomor atom dari kiri ke kanan.
- Golongan:
- Kolom vertikal (1 sampai 18). Unsur segolongan memiliki elektron valensi yang mirip, sehingga sifat kimia serupa. Misal, Golongan 1 adalah logam alkali (Li, Na, K), Golongan 17 adalah halogen (F, Cl, Br), dsb.
- Periode:
- Baris horizontal (1 sampai 7). Menunjukkan tingkat energi utama atau kulit yang ditempati elektron.
- Blok:
- Blok s (Golongan 1 & 2),
- Blok p (Golongan 13–18),
- Blok d (Logam Transisi, Golongan 3–12),
- Blok f (Lantanida dan Aktinida).
3. Contoh Unsur dan Letaknya di Tabel
- Hidrogen (H): Nomor atom 1, berada di Golongan 1, Periode 1.
- Kalsium (Ca): Nomor atom 20, di Golongan 2, Periode 4 (alkali tanah).
- Besi (Fe): Nomor atom 26, di Golongan 8, Periode 4 (logam transisi).
- Iodin (I): Nomor atom 53, di Golongan 17, Periode 5 (halogen).
- Emas (Au): Nomor atom 79, di Golongan 11, Periode 6 (logam mulia).
Tabel Periodik Lengkap
| Tabel Periodik | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Golongan | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||
| Logam alkali | Logam alkali tanah | Pniktogen | Kalkogen | Halogen | Gas Mulia | |||||||||||||||||||||||
| Periode1 | ||||||||||||||||||||||||||||
| 2 | ||||||||||||||||||||||||||||
| 3 | ||||||||||||||||||||||||||||
| 4 | ||||||||||||||||||||||||||||
| 5 | ||||||||||||||||||||||||||||
| 6 | ||||||||||||||||||||||||||||
| 7 | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Cara Membaca Dan Menghafal Tabel Diatas Dengan Mudah
Tabel periodik berisi sel informatif untuk setiap unsur yang disusun dengan meningkatkan jumlah atom dan sifat kimia.
Klik disini untuk mengetahui cara membaca dan menghafalkannya.
Daftar Unsur Kimia Menurut Nama – Tabel Periodik
Berikut adalah daftar unsur kimia dalam tabel peiodik, diurutkan berdasarkan nama dan warna menunjukkan jenis unsur.
Pada masing-masing unsur meliputi: lambang unsur, nomor atom, massa atom atau isotop yang paling stabil, serta golongan dan nomor periode dalam tabel periodik.
(Ubah layar Anda menjadi horisontal, jika Anda menggunakan handphone, agar tabel periodik bisa tampildan dibaca dengan baik)
Deret kimia tabel periodik
| Logam alkali | Alkali tanah | Lantanida | Aktinida | Logam transisi |
| Logam | Metaloid | Nonlogam | Halogen | Gas mulia |
| Nama | Lambang | Nomor atom | Massa atom | Golongan | Periode |
|---|---|---|---|---|---|
| Aktinium | Ac | 89 | [227]1 | 7 | |
| Aluminium | Al | 13 | 26,9815386(8) | 13 | 3 |
| Amerisium | Am | 95 | [243]1 | 7 | |
| Antimon(Stibium) | Sb | 51 | 121,760(1)2 | 15 | 5 |
| Argentum → Perak | Ag | 47 | 107,8682(2)2 | 11 | 5 |
| Argon | Ar | 18 | 39,948(1)2 4 | 18 | 3 |
| Arsenik | As | 33 | 74,92160(2) | 15 | 4 |
| Astatin | At | 85 | [210]1 | 17 | 6 |
| Aurum → Emas | Au | 79 | 196,966569(4) | 11 | 6 |
| Barium | Ba | 56 | 137,327(7) | 2 | 6 |
| Belerang(Sulfur) | S | 16 | 32,065(5)2 4 | 16 | 3 |
| Berkelium | Bk | 97 | [247]1 | 7 | |
| Berilium | Be | 4 | 9,012182(3) | 2 | 2 |
| Besi (Ferrum) | Fe | 26 | 55,845(2) | 8 | 4 |
| Bismut | Bi | 83 | 208,98040(1) | 15 | 6 |
| Bohrium | Bh | 107 | [264]1 | 7 | 7 |
| Boron | B | 5 | 10,811(7)2 3 4 | 13 | 2 |
| Bromin | Br | 35 | 79,904(1) | 17 | 4 |
| Cuprum →Tembaga | Cu | 29 | 63,546(3)4 | 11 | 4 |
| Darmstadtium | Ds | 110 | [271]1 | 10 | 7 |
| Dubnium | Db | 105 | [262]1 | 5 | 7 |
| Disprosium | Dy | 66 | 162,500(1)2 | 6 | |
| Einsteinium | Es | 99 | [252]1 | 7 | |
| Emas(Aurum) | Au | 79 | 196,966569(4) | 11 | 6 |
| Erbium | Er | 68 | 167,259(3)2 | 6 | |
| Europium | Eu | 63 | 151,964(1)2 | 6 | |
| Fermium | Fm | 100 | [257]1 | 7 | |
| Ferrum →Besi | Fe | 26 | 55,845(2) | 8 | 4 |
| Flerovium | Fl | 114 | [289]1 | 14 | 7 |
| Fluor | F | 9 | 18,9984032(5) | 17 | 2 |
| Fosfor | P | 15 | 30,973762(2) | 15 | 3 |
| Fransium | Fr | 87 | [223]1 | 1 | 7 |
| Gadolinium | Gd | 64 | 157,25(3)2 | 6 | |
| Galium | Ga | 31 | 69,723(1) | 13 | 4 |
| Germanium | Ge | 32 | 72,64(1) | 14 | 4 |
| Hafnium | Hf | 72 | 178,49(2) | 4 | 6 |
| Hassium | Hs | 108 | [277]1 | 8 | 7 |
| Helium | He | 2 | 4,002602(2)2 4 | 18 | 1 |
| Hidrogen | H | 1 | 1,00794(7)2 3 4 | 1 | 1 |
| Holmium | Ho | 67 | 164,930 32(2) | 6 | |
| Hydrargyrum →Raksa | Hg | 80 | 200,59(2) | 12 | 6 |
| Indium | In | 49 | 114,818(3) | 13 | 5 |
| Iodine→Yodium | I | 53 | 126,904 47(3) | 17 | 5 |
| Iridium | Ir | 77 | 192,217(3) | 9 | 6 |
| Iterbium | Yb | 70 | 173,04(3)2 | 6 | |
| Itrium | Y | 39 | 88,90585(2) | 3 | 5 |
| Kadmium | Cd | 48 | 112,411(8)2 | 12 | 5 |
| Kalium | K | 19 | 39,0983(1) | 1 | 4 |
| Kalsium | Ca | 20 | 40,078(4)2 | 2 | 4 |
| Kalifornium | Cf | 98 | [251]1 | 7 | |
| Karbon | C | 6 | 12,0107(8)2 4 | 14 | 2 |
| Klorin | Cl | 17 | 35,453(2)2 3 4 | 17 | 3 |
| Kromium | Cr | 24 | 51,9961(6) | 6 | 4 |
| Kobalt | Co | 27 | 58,933195(5) | 9 | 4 |
| Kopernisium | Cn | 112 | [285]1 | 12 | 7 |
| Kurium | Cm | 96 | [247]1 | 7 | |
| Kripton | Kr | 36 | 83,798(2)2 3 | 18 | 4 |
| Lantanum | La | 57 | 138,90547(7)2 | 6 | |
| Lawrensium | Lr | 103 | [262]1 | 3 | 7 |
| Litium | Li | 3 | 6,941(2)2 3 4 5 | 1 | 2 |
| Livermorium | Lv | 116 | [292]1 | 16 | 7 |
| Lutesium | Lu | 71 | 174,967(1)2 | 3 | 6 |
| Magnesium | Mg | 12 | 24,3050(6) | 2 | 3 |
| Mangan | Mn | 25 | 54,938045(5) | 7 | 4 |
| Meitnerium | Mt | 109 | [268]1 | 9 | 7 |
| Mendelevium | Md | 101 | [258]1 | 7 | |
| Molibdenum | Mo | 42 | 95,94(2)2 | 6 | 5 |
| Natrium | Na | 11 | 22,98976928(2) | 1 | 3 |
| Neodimium | Nd | 60 | 144,242(3)2 | 6 | |
| Neon | Ne | 10 | 20,1797(6)2 3 | 18 | 2 |
| Neptunium | Np | 93 | [237]1 | 7 | |
| Nikel | Ni | 28 | 58,6934(2) | 10 | 4 |
| Niobium | Nb | 41 | 92,906 38(2) | 5 | 5 |
| Nitrogen | N | 7 | 14,0067(2)2 4 | 15 | 2 |
| Nobelium | No | 102 | [259]1 | 7 | |
| Osmium | Os | 76 | 190,23(3)2 | 8 | 6 |
| Oksigen | O | 8 | 15,9994(3)2 4 | 16 | 2 |
| Paladium | Pd | 46 | 106,42(1)2 | 10 | 5 |
| Perak(Argentum) | Ag | 47 | 107,8682(2)2 | 11 | 5 |
| Plumbum→Timbal | Pb | 82 | 207,2(1)2 4 | 14 | 6 |
| Potasium→Kalium | K | 19 | 39,0983(1) | 1 | 4 |
| Sodium→Natrium | Na | 11 | 22,98976928(2) | 1 | 3 |
| Platina | Pt | 78 | 195,084(9) | 10 | 6 |
| Plutonium | Pu | 94 | [244]1 | 7 | |
| Polonium | Po | 84 | [210]1 | 16 | 6 |
| Praseodimium | Pr | 59 | 140,90765(2) | 6 | |
| Prometium | Pm | 61 | [145]1 | 6 | |
| Protaktinium | Pa | 91 | 231,03588(2)1 | 7 | |
| Radium | Ra | 88 | [226]1 | 2 | 7 |
| Radon | Rn | 86 | [220]1 | 18 | 6 |
| Raksa(Hydrargyrum) | Hg | 80 | 200,59(2) | 12 | 6 |
| Renium | Re | 75 | 186,207(1) | 7 | 6 |
| Rodium | Rh | 45 | 102,905 50(2) | 9 | 5 |
| Roentgenium | Rg | 111 | [272]1 | 11 | 7 |
| Rubidium | Rb | 37 | 85,4678(3)2 | 1 | 5 |
| Rutenium | Ru | 44 | 101,07(2)2 | 8 | 5 |
| Rutherfordium | Rf | 104 | 2611 | 4 | 7 |
| Samarium | Sm | 62 | 150,36(2)2 | 6 | |
| Skandium | Sc | 21 | 44,955912(6) | 3 | 4 |
| Seaborgium | Sg | 106 | [266]1 | 6 | 7 |
| Selenium | Se | 34 | 78,96(3)4 | 16 | 4 |
| Serium | Ce | 58 | 140,116(1)2 | 6 | |
| Sesium | Cs | 55 | 132,9054519(2) | 1 | 6 |
| Silikon | Si | 14 | 28,0855(3)4 | 14 | 3 |
| Seng | Zn | 30 | 65,409(4) | 12 | 4 |
| Stannum→Timah | Sn | 50 | 118,710(7)2 | 14 | 5 |
| Stibium→Antimon | Sb | 51 | 121,760(1)2 | 15 | 5 |
| Stronsium | Sr | 38 | 87,62(1)2 4 | 2 | 5 |
| Talium | Tl | 81 | 204,3833(2) | 13 | 6 |
| Tantalum | Ta | 73 | 180,94788(2) | 5 | 6 |
| Teknesium | Tc | 43 | [98]1 | 7 | 5 |
| Telurium | Te | 52 | 127,60(3)2 | 16 | 5 |
| Tembaga (Cuprum) | Cu | 29 | 63,546(3)4 | 11 | 4 |
| Terbium | Tb | 65 | 158,92535(2) | 6 | |
| Timah(Stannum) | Sn | 50 | 118,710(7)2 | 14 | 5 |
| Timbal(Plumbum) | Pb | 82 | 207,2(1)2 4 | 14 | 6 |
| Titanium | Ti | 22 | 47,867(1) | 4 | 4 |
| Torium | Th | 90 | 232,03806(2)1 2 | 7 | |
| Tulium | Tm | 69 | 168,93421(2) | 6 | |
| Tungsten → Wolfram | W | 74 | 183,84(1) | 6 | 6 |
| Ununoktium → Oganeson | Uuo | 118 | [294]1 | 18 | 7 |
| Ununpentium → Moskovium | Uup | 115 | [288]1 | 15 | 7 |
| Ununtrium → Nihonium | Uut | 113 | [284]1 | 13 | 7 |
| Uranium | U | 92 | 238,02891(3)1 2 3 | 7 | |
| Vanadium | V | 23 | 50,9415(1) | 5 | 4 |
| Wolfram (Tungsten) | W | 74 | 183,84(1) | 6 | 6 |
| Xenon | Xe | 54 | 131,293(6)2 3 | 18 | 5 |
| Yodium → Iodin | I | 53 | 126,904 47(3) | 17 | 5 |
| Zinc → Seng | Zn | 30 | 65,409(4) | 12 | 4 |
| Zirkonium | Zr | 40 | 91,224(2)2 | 4 | 5 |
| Logam alkali | Alkali tanah | Lantanida | Aktinida | Logam transisi |
| Logam | Metaloid | Nonlogam | Halogen | Gas mulia |
4. Golongan dan Sifat Kimia Utama
- Golongan 1 (Logam Alkali)
- Contoh: Li, Na, K.
- Reaktif, bereaksi cepat dengan air membentuk basa kuat.
- Golongan 2 (Alkali Tanah)
- Contoh: Be, Mg, Ca.
- Kurang reaktif dibanding alkali, namun tetap mudah membentuk senyawa ionik.
- Golongan 17 (Halogen)
- Contoh: F, Cl, Br, I.
- Sangat reaktif, suka membentuk garam dengan logam.
- Golongan 18 (Gas Mulia)
- Contoh: He, Ne, Ar, Kr, Xe, Rn.
- Inert (sangat stabil), konfigurasi elektron valensi penuh.
- Logam Transisi (Golongan 3–12)
- Contoh: Fe, Cu, Ag, Au.
- Sering membentuk ion bermuatan ganda, banyak digunakan sebagai katalis.
5. Tips Membaca Tabel Periodik
- Kolom (Golongan) Menentukan Elektron Valensi
- Unsur dalam golongan sama cenderung membentuk oksida atau halida serupa.
- Baris (Periode) Menentukan Jumlah Kulit
- Kian ke bawah periode, kian banyak kulit elektron yang terisi.
- Urutan Nomor Atom
- Menunjukkan peningkatan proton dan total elektron (bila netral).
Baca Juga: Cara Mudah Menghafal Tabel Periodik (Chem LibreTexts)
6. Manfaat Tabel Periodik
- Memprediksi Sifat Unsur Baru
- Dengan melihat posisi di tabel, kita menebak reaktivitas, titik leleh, dll.
- Menentukan Konfigurasi Elektron
- Unsur di Blok s, p, d, f memiliki pola konfigurasi tertentu.
- Menjelaskan Ikatan Kimia
- Unsur golongan 1 (alkali) cenderung membentuk ikatan ion dengan halogen di golongan 17.
- Menyederhanakan Belajar Kimia
- Membantu kita menstrukturkan informasi 118 unsur (per 2023).
7. Tabel Periodik dalam Bentuk Umum
Golongan 1 (Logam Alkali): H, Li, Na, K, Rb, Cs, Fr
Golongan 2 (Alkali Tanah): Be, Mg, Ca, Sr, Ba, Ra
Golongan 17 (Halogen): F, Cl, Br, I, At, Ts
Golongan 18 (Gas Mulia): He, Ne, Ar, Kr, Xe, Rn, Og
Contoh Tabel Singkat:
| Gol | Unsur Contoh | Karakteristik |
|---|---|---|
| 1 | Li, Na, K | Sangat reaktif, pembentuk basa |
| 2 | Be, Mg, Ca | Reaktif moderat |
| 17 | Cl, Br, I | Pembentuk garam, reaktif |
| 18 | He, Ne, Ar | Gas mulia, inert |
8. Batas Pengetahuan dan Unsur Super Berat
- Unsur di atas nomor atom 104 (Rutherfordium) biasanya bersifat sintetis dan tidak stabil.
- Penamaannya pun sering sementara (Unun-), lalu diganti saat resmi diakui IUPAC.
Contoh:
- Ununpentium → Moscovium (Mc)
- Ununoctium → Oganesson (Og)
9. Info Penting
- Perkembangan Terkini
- Penemuan unsur baru (Z=119, 120) masih dalam penelitian.
- Nomor Oksidasi & Sifat Kimia
- Tabel periodik juga dilengkapi nomor oksidasi umum.
- Fase Unsur
- Warna terkadang menandakan fase (padat, cair, gas) pada suhu kamar.
- Aplikasi
- Industri (menentukan logam transisi sebagai katalis),
- Penelitian material (mencari sifat semikonduktor, logam paduan, dsb.).
10. Kesimpulan
- Tabel Periodik memuat semua unsur kimia yang diketahui, disusun berdasarkan nomor atom dan konfigurasi elektron.
- Golongan (kolom) dan periode (baris) memudahkan identifikasi sifat kimia, konfigurasi elektron valensi, dan kesamaan perilaku unsur.
- Dengan memahami tabel periodik, kita dapat memprediksi reaksi, mengenali ikatan kimia, dan menelusuri unsur yang belum banyak dipelajari.
Rekomendasi Bacaan:
Bacaan Lainnya
- Tabel Alkana Alkena Alkuna – Senyawa Hidrokarbon – Rumus Molekul – Beserta Contoh Soal dan Jawaban
- Fraksi Mol Kimia “Xi” – Rumus, Penjelasan, Contoh Soal dan Jawaban
- Zat Kimia – Penjelasan, Contoh, Kegunaan
- Jenis Senyawa : Asam, Basa, Ionik, Garam, Oksida dan Organik
- Asam Basa pH – Rumus Kimia, Penjelasan, Contoh Soal dan Jawaban
- Asam Basa Konjugat – Konjugasi Asam Basa & Rumus, Konjugat, Contoh Soal dan Jawaban
- pH Derajat Keasaman, p[H], pOH – Rumus, Soal dan Jawaban
- Rumus Kimia Konsep Mol Dan Empiris Beserta Contoh Soal Dan Jawaban
- Surfaktan Senyawa Organik – Penjelasan, Contoh Soal dan Jawaban
- Nama Obat dan Untuk Penyakit Apa ? – Daftar Nama Obat Esensial diterbitkan oleh Organisasi Kesehatan Dunia (WHO)
- Fraksi Mol Kimia”Xi” – Rumus, Penjelasan, Contoh Soal dan Jawaban
- Bagaimana Laut Mati / Dead Sea Mendapatkan Namanya? Mengapa Anda Dapat Mengapung Di Laut Mati?
- 10 Kegiatan Yang Akan Membantu Otak Anda Menjadi Tetap Muda Dan Tajam
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan sering terdengar jika Anda memasang applikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Sumber bacaan: Wikipedia, Royal Society of Chemistry, IUPAC, LANL, NIST Chemistry WebBook
Cocok buat tugas sekolah, sangat komplit sekali.
Terimakasih banyak min.
Sama-sama Adam Muiz. Selamat membaca dan belajar! 🙂
Komplit banget, tabel disusun berdasarkan nomor atom.
Gampang dicari menurut warna & jenis unsur.
Sekarang cuma tinggal menghafalkan aja ?
Makasih Michael, selamat menghafalkan ya ?
Artikel ini dapat membantu Anda untuk menghafalkannya: https://www.pinterpandai.com/cara-membaca-dan-menghafal-tabel-periodik