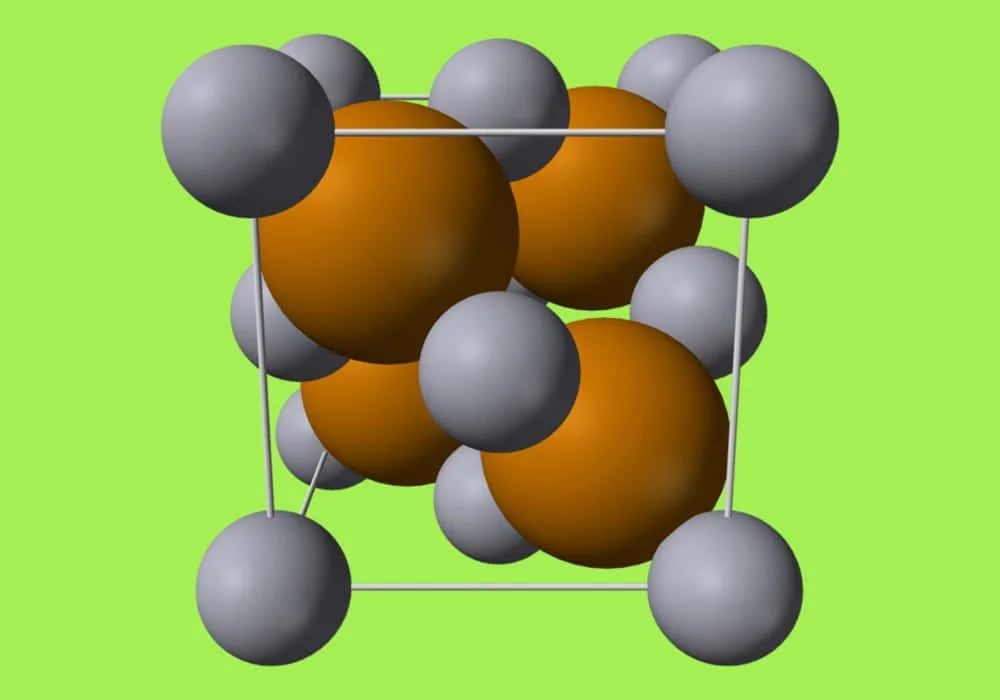
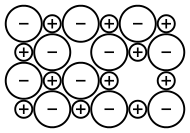
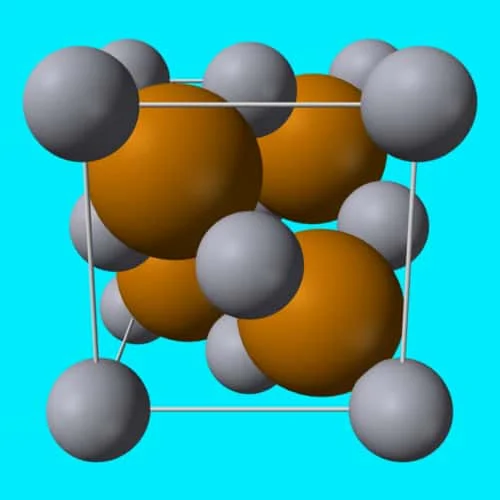
Senyawa Ionik
Dalam kimia, senyawa ionik adalah senyawa kimia yang tersusun dari ion-ion yang disatukan oleh gaya elektrostatik yang disebut ikatan ionik.
Senyawa ini netral secara keseluruhan, tetapi terdiri dari ion bermuatan positif yang disebut kation dan ion bermuatan negatif yang disebut anion. Ini bisa berupa ion sederhana seperti natrium (Na+) dan klorida (Cl−) dalam natrium klorida, atau spesies poliatomik seperti ion amonium (NH+4) dan karbonat (CO2−3) dalam amonium karbonat. Masing-masing ion dalam senyawa ionik biasanya memiliki beberapa tetangga terdekat, jadi tidak dianggap sebagai bagian dari molekul, tetapi merupakan bagian dari jaringan tiga dimensi kontinu; ini biasanya dalam struktur kristal.
Kandungan dalam senyawa ionik
Senyawa ionik yang mengandung ion hidrogen (H+) diklasifikasikan sebagai asam, sedangkan yang mengandung ion basa hidroksida (OH−) atau oksida (O2−) diklasifikasikan sebagai basa. Senyawa ionik tanpa ion-ion di atas juga dikenal sebagai garam dan dapat terbentuk melalui reaksi asam basa. Senyawa ionik juga dapat dihasilkan dari ion konstituennya melalui penguapan pelarutnya, presipitasi, pembekuan, reaksi zat padat, atau reaksi transfer elektron logam reaktif dengan nonlogam reaktif, seperti gas halogen.
Senyawa ionik biasanya memiliki titik leleh dan titik didih yang tinggi, dan keras dan rapuh. Sebagai padatan mereka hampir selalu menyekat listrik, tapi saat meleleh atau larut mereka menjadi sangat konduktif, karena mobilisasi ion-ionnya.
Tata nama senyawa berikatan ionik
Pemberian nama untuk senyawa ionik (menurut IUPAC) adalah penggabungan antara nama ion positif dan ion negatif. Jumlah atom dalam senyawa tidak dihitung (tanpa menggunakan awalan mono-, di-, tri-, dst.).
(tanpa menggunakan awalan mono-, di-, tri-, dst)
Dalam tabel berikut disajikan beberapa nama ion positif dan negatif monoatomik dari unsur golongan A:
| ||||||||||||||||||||||||||||||||||||||||||
catatan:
Ada beberapa unsur golongan A yang tidak dicantumkan dalam tabel di atas, karena tidak umum dijumpai dalam pembahasan senyawa berikatan ionik. Unsur tersebut adalah:
- Unsur-unsur yang dianggap sudah stabil, sehingga tidak membentuk ikatan ionik. contoh: seluruh unsur golongan VIII A (gas mulia).
- Unsur-unsur non logam yang lebih cenderung berikatan kovalen. Contoh: karbon (C), silikon (Si), dll.
- Unsur-unsur logam yang dapat membentuk ion positif, tetapi memiliki beberapa nilai bilangan oksidasi. Penamaannya akan mengikuti aturan penamaan senyawa redoks (dibahas dalam tutorial tersendiri). Contoh: timbal (Pb), timah (Sn), dll.
Contoh
Tuliskan nama untuk senyawa-senyawa berikut: LiI, K3N, AlI3, dan BeF2!Jawab:
| LiI | = | Lithium iodida |
| K3N | = | Kalium nitrida |
| AlI3 | = | Aluminium iodida |
| BeF2 | = | Berilium fluorida |
Ion Khusus
Ada ion yang tidak hanya terdiri dari satu atom (monoatomik), melainkan beberapa atom (poliatomik). Ion-ion ini memiliki nama khusus dan biasanya terdiri dari unsur-unsur nonlogam.
Pembahasan ion-ion ini akan kita jumpai pada materi Asam-Basa. Karena sering digunakan bersama ion monoatomik, sebagai bahan perbandingan, berikut kami sajikan beberapa nama ion poliatomik.
| ||||||||||||||||||||||
Daftar lengkap nama ion-ion khusus dapat dilihat di buku pelajaran pada materi Asam-Basa.
Contoh
Tuliskan nama untuk senyawa-senyawa berikut: LiNO3, K2SO4, NH4Cl, dan (NH4)2CO3!
Jawab:
| LiNO3 | = | Lithium nitrat |
| K2SO4 | = | Kalium sulfat |
| NH4Cl | = | Amonium klorida |
| (NH4)2CO3 | = | Amonium karbonat |
Rumus Kimia Senyawa Ionik
Untuk menentukan rumus kimia senyawa ion dari ion-ion penyusunnya, perhatikan beberapa langkah berikut ini:
Tabel Muatan Total Ion dalam Senyawa
Ion dan Senyawa | Na+ Na+ | CO32- | Na2CO3 |
Muatan Total | 2+ | 2– | 0 |
Ion dan Senyawa | Al3+ Al3+ | SO42- SO42- SO42- | Al2(SO4)3 |
Muatan Total | 6+ | 6– | 0 |
Tabel Rumus Kimia Senyawa Ion
Nama Senyawa | Ion | Rumus Kimia | |
Positif | Negatif | ||
Natrium Hidroksida | Na+ | OH– | NaOH |
Kalium nitrat | K+ | NO3– | KNO3 |
Amonium sulfat | NH4+ | SO42– | (NH4)2SO4 |
Kalsium karbonat | Ca2+ | CO32– | CaCO3 |
Kalsium bikarbonat | Ca2+ | HCO3– | Ca(HCO3)2 |
Magnesium klorida | Mg2+ | Cl– | MgCl2 |

Cara dan Aturan Penulisan Nama Senyawa Ionik: Kation dan Anion
Tabel Nama-Nama Kation
Kation +1 | +2 | +3 | +4 | ||||
Nama | Lambang | Nama | Lambang | Nama | Lambang | Nama | Lambang |
Litium | Li+ | Magnesium | Mg2+ | Aluminium | Al3+ | Timah(IV) | Sn4+ |
Na+ | Kalsium | Ca2+ | Kromium | Cr3+ | Timbal(IV) | Pb4+ | |
K+ | Barium | Ba2+ | Besi(III) | Fe3+ | |||
Sesium | Cs+ | Seng | Zn2+ | ||||
Ag+ | Nikel | Ni2+ | |||||
Amonium | NH4+ | Besi(I) | Fe2+ | ||||
Tembaga(I) | Cu+ | Tembaga(II) | Cu2+ | ||||
Tabel Nama-Nama Anion
Anion –1 | –2 | –3 | –4 | ||||
Nama | Lambang | Nama | Lambang | Nama | Lambang | Nama | Lambang |
Fluorida | F– | Oksida | O2- | Nitrida | N3- | Karbida | C4- |
Klorida | Cl– | Sulfida | S2- | Fosfida | P3- | ||
Bromida | Br– | Sulfat | SO42- | Fosfat | PO43- | ||
Iodida | I– | Sulfit | SO32- | Fosfit | PO33- | ||
Nitrit | NO2– | Karbonat | CO32- | ||||
Nitrat | NO3– | Dikromat | Cr2O72- | ||||
CN– | Kromat | CrO42- | |||||
Tata Nama Senyawa Ion Biner
CaBr2Ca: kalsiumBr2: Brom + ida = Bromida
NaCl | = | Natrium klorida | CaS | = | Kalsium sulfida |
NaBr | = | Natrium bromida | CaO | = | Kalsium oksida |
KI | = | Kalium iodida | MgBr2 | = | Magnesium bromida |
KF | = | Kalium fluorida | BaCl2 | = | Barium klorida |
Tata Nama Senyawa Ion Poliatomik
NO3– | = | Nitrat | NO2– | = | Nitrit |
SO42- | = | Sulfat | SO32- | = | Sulfit |
PO42- | = | Fosfat | PO32- | = | Fosfit |
NaNO2 | = | Natrium nitrit | CaSO4 | = | Kalsium sulfat |
NaNO3 | = | Natrium nitrat | MgCO3 | = | Magnesium karbonat |
K2SO3 | = | Kalium sulfit | Ba(NO3)2 | = | Barium nitrat |
K2SO4 | = | Kalium sulfat | Al2(SO4)3 | = | Aluminium sulfat |
NaClO | = | Natrium hipoklorit |
NaClO2 | = | Natrium klorit |
NaClO3 | = | Natrium klorat |
NaClO4 | = | Natrium perklorat |

Contoh Soal dan Pembahasan Tata Nama Senyawa Ionik
Contoh Soal #1
a)Kalsium sulfida b)Natrium oksida c)Zink oksida d)Alumunium klorida | e)Besi(II) sulfida f)Raksa(II) klorida g)Timah(IV) sulfida h)Timbal(II) bromida |
a)Kalsium sulfida Kation = kalsium (Ca2+) Anion = sulfida (S2-) Reaksi : Ca2+ + S2- → CaS Rumus = CaS b)Natrium oksida Kation = natrium (Na+) Anion = oksida (O2-) Reaksi : Na+ + O2- → Na2O Rumus = Na2O c)Zink oksida Kation = zink (Zn2+) Anion = oksida (O2-) Reaksi : Zn2+ + O2- → ZnO Rumus = ZnO d)Alumunium klorida Kation = alumunium (Al3+) Anion = klorida (Cl–) Reaksi : Al3+ + Cl– → AlCl3 Rumus = AlCl3 | e)Besi(II) sulfida Kation = besi(II) (Fe2+) Anion = sulfida (S2-) Reaksi : Fe2+ + S2- → FeS Rumus = FeS f)Raksa(II) klorida Kation = raksa(II) (Hg2+) Anion = klorida (Cl–) Reaksi : Hg2+ + Cl– → HgCl2 Rumus = HgCl2 g)Timah(IV) sulfida Kation = timah(IV) (Sn4+) Anion = sulfida (S2-) Reaksi : Sn4+ + S2- → SnS2 Rumus = SnS2 h)Timbal(II) bromida Kation = timbal(II) (Pb2+) Anion = bromida (Br–) Reaksi : Pb2+ + Br– → PbBr2 Rumus = PbBr2 |
Contoh Soal #2
Kation/Anion | Cl– | O2- | NO3- | SO4- | PO4- |
Na+ | |||||
Cu2+ | |||||
Hg2+ | |||||
Fe3+ | |||||
Al3+ |
Kation/Anion | Cl– | O2- | NO3- | SO4- | PO4- |
Na+ | NaCl | Na2O | NaNO3 | Na2SO4 | Na3PO4 |
Cu2+ | CuCl2 | CuO | Cu(NO3)2 | CuSO4 | Cu3(PO4)2 |
Hg2+ | HgCl2 | HgO | Hg(NO3)2 | HgSO4 | Hg3(PO4)2 |
Fe3+ | FeCl3 | Fe2O3 | Fe(NO3)3 | Fe2(SO4)3 | FePO4 |
Al3+ | AlCl3 | Al2O3 | Al(NO3)3 | Al2(SO4)3 | AlPO4 |
Sejarah Penemuan Senyawa Ionik
Kata ion adalah istilah Yunani ἰόν, ion, “going (bahasa Indonesia: pergi)”, kata kerja bentuk sedang mengerjakan dari ἰέναι, ienai, “to go“. Istilah ini diperkenalkan oleh fisikawan dan kimiawan Michael Faraday pada tahun 1834 untuk spesies yang tidak dikenal yang berpindah dari satu elektrode ke elektroda lainnya melalui media berair.
Pada tahun 1913, struktur kristal natrium klorida ditentukan oleh William Henry Bragg dan William Lawrence Bragg.
Ini mengungkapkan bahwa terdapat enam tetangga terdekat yang sama untuk masing-masing atom. Hal ini menunjukkan bahwa unsur-unsur tersebut tidak diatur dalam molekul atau agregat terbatas, melainkan sebagai jaringan dengan tatanan kristal jarak jauh.
Banyak senyawa anorganik lainnya juga dijumpai memiliki ciri struktural yang serupa.
Senyawa ini segera digambarkan tersusun dari ion-ion bukan dari beberapa atom netral, tetapi hipotesis ini tidak dapat dibuktikan sampai pertengahan 1920-an, saat dilakukan percobaan refleksi sinar-X (yang mendeteksi kerapatan elektron).
Kontributor utama pengembangan perlakuan teoretis struktur kristal ion adalah Max Born, Fritz Haber, Alfred Landé, Erwin Madelung, Paul Peter Ewald, dan Kazimierz Fajans. Prediksi born tentang energi kristal berdasarkan asumsi konstituen ionik, yang menunjukkan hubungan yang baik dengan pengukuran termokimia, selanjutnya mendukung asumsi tersebut.
Pembentukan Senyawa Ionik
Senyawa ionik dapat dibuat dari ion konstituennya dengan:
penguapan, presipitasi, atau pembekuan. Logam reaktif seperti logam alkali dapat bereaksi langsung dengan gas halogen yang sangat elektronegatif membentuk produk ionik. Mereka juga dapat disintesis sebagai produk dari reaksi antar padatan pada suhu tinggi.
Jika senyawa ionik larut dalam pelarut, senyawa ini dapat diperoleh sebagai senyawa padat dengan menguapkan pelarutnya dari larutan elektrolit ini.
Ketika pelarut diuapkan, ion tidak ikut menguap, tetapi tetap berada di larutan yang tertinggal, dan bila sudah cukup pekat, terjadilah nukleasi, dan mengkristal menjadi senyawa ionik. Proses ini terjadi secara luas di alam, dan merupakan cara pembentukan mineral evaporit. Metode lain untuk mendapatkan kembali senyawa dari larutannya melibatkan penjenuhan larutan pada suhu tinggi dan kemudian mengurangi kelarutannya dengan menurunkan suhu sampai larutan tersebut superjenuh dan senyawa padat ternukleasi.
Senyawa ion yang tidak larut dapat diendapkan dengan mencampur dua larutan, satu dengan kation dan satu lagi dengan anion di dalamnya. Oleh karena semua larutan bersifat netral secara kelistrikan, kedua larutan yang dicampur juga harus mengandung ion lawan dari muatan yang berlawanan. Untuk memastikan bahwa ion lawan ini tidak mencemari senyawa ionik yang diendapkan, penting untuk dipastikan agar ion lawan tidak ikut mengendap. Jika kedua larutan tersebut menggunakan ion hidrogen dan ion hidroksida sebagai ion lawan, mereka akan bereaksi satu sama lain dalam reaksi asam–basa atau reaksi netralisasi membentuk air. Sebagai alternatif, ion lawan dapat dipilih untuk memastikan bahwa bahkan jika digabungkan dalam satu larutan tunggal, mereka akan tetap larut sebagai ion tribun.
Jika pelarutnya adalah air baik dalam metode penguapan atau pembentukan endapan, dalam banyak kasus kristal ionik yang terbentuk juga mencakup air kristal, sehingga produk tersebut dikenal sebagai hidrat, dan dapat memiliki sifat kimia yang sangat berbeda.
Lelehan garam cair akan memadat pada pendinginan sampai di bawah titik bekunya. Ini kadang-kadang digunakan untuk sintesis benda padat senyawa ion kompleks dari reaktan padat, yang sebelumnya telah dicairkan bersamaan.
Dalam kasus lain, reaktan padat tidak perlu dicairkan, tetapi bisa bereaksi melalui jalur reaksi benda padat. Dalam metode ini, reaktan digiling berulang-ulang sampai halus dan menjadi pasta, kemudian dipanaskan sampai suhu dimana ion-ion reaktan tetangga dapat berdifusi bersamaan selama campuran reaktan tetap berada dalam oven. Jalur sintetis lainnya menggunakan prekursor padat ion non-volatil dengan rasio stoikiometri yang tepat, yang dipanaskan untuk menghilangkan spesies lainnya.
Dalam beberapa reaksi antara logam yang sangat reaktif (biasanya dari Golongan 1 atau Golongan 2) dan gas halogen yang sangat elektronegatif, atau air, atom-atom dapat diionisasi melalui transfer elektron, sebuah proses yang secara termodinamika dapat dipahami dengan menggunakan siklus Born–Haber.
Ikatan Senyawa Ionik

Diagram skematik kelopak elektron dari atom natrium dan fluor yang mengalami reaksi redoks membentuk natrium fluorida. Natrium kehilangan elektron terluarnya untuk mendapatkan konfigurasi elektron yang stabil, dan elektron ini memasuki atom fluor secara eksotermik. Ion dengan muatan berlawanan – biasanya cukup banyak – kemudian tertarik satu sama lain membentuk padatan.
Ion dalam senyawa ionik terutama disatukan oleh gaya elektrostatik antar distribusi muatan dari benda-benda ini, dan khususnya ikatan ion yang dihasilkan dari daya tarik Coulomb jarak jauh antara muatan negatif anion dan muatan positif kation. Terdapat pula gaya tarik tambahan dari interaksi van der Waals yang hanya menyumbang sekitar 1–2% energi kohesif untuk ion kecil.
Ketika sepasang ion cukup dekat untuk mengalami tumpangsuh antar kelopak elektron terluarnya (kebanyakan ion sederhana memiliki kelopak tertutup), terjadi gaya repulsif jarak pendek, karena prinsip pengecualian Pauli.
Keseimbangan antara kekuatan ini menyebabkan energi potensial sama dengan energi minimum ketika inti dipisahkan oleh jarak kesetimbangan tertentu.
Jika struktur elektron dari kedua badan yang saling berinteraksi dipengaruhi oleh adanya satu sama lain, interaksi kovalen (non-ionik) juga berkontribusi pada energi keseluruhan senyawa yang terbentuk.
Senyawa ionik jarang murni ionik, yaitu disatukan hanya dengan gaya elektrostatik. Ikatan antara pasangan paling elektronegatif/elektropositif seperti yang ada pada sesium fluorida menunjukkan tingkat kovalensi yang kecil. Sebaliknya, ikatan kovalen antara atom yang tidak sejenis sering menunjukkan pemisahan muatan dan dapat dianggap memiliki karakter ionik parsial.
Keadaan di mana senyawa akan memiliki sifat ionik atau kovalen biasanya dapat dipahami dengan menggunakan aturan Fajans, yang hanya menggunakan muatan dan ukuran masing-masing ion. Menurut aturan ini, senyawa dengan karakter paling ionik akan memiliki ion positif berukuran besar dengan muatan rendah, yanh terikat pada ion negatif berukuran kecil dengan muatan tinggi.
Secara umum, teori HSAB dapat diterapkan, untuk senyawa dengan karakter paling ionik adalah yang terdiri dari asam kuat dan basa kuat: ion kecil bermuatan sangat tinggi dengan perbedaan elektronegativitas yang tinggi antara anion dan kation. Perbedaan dalam elektronegativitas ini berarti bahwa pemisahan muatan, dan momen dipol yang dihasilkan, dipertahankan bahkan ketika ion-ion tersebut bersentuhan (elektron berlebih pada anion tidak ditransfer maupun terpolarisasi untuk menetralkan kation).
Struktur Senyawa Ionik
Ion biasanya dikemas ke dalam struktur kristal reguler, dalam pengaturan yang meminimalkan energi kisi (memaksimalkan daya tarik dan meminimalkan tolakan). Energi kisi adalah penjumlahan dari interaksi semua situs dengan semua situs lainnya. Untuk ion sferis yang tak terpolarisasi, penentuan energi interaksi elektrostatik hanya memerlukan muatan dan jarak. Untuk struktur kristal ideal tertentu, semua jarak terkait dengan jarak antar inti terkecil secara geometris. Jadi untuk setiap struktur kristal yang mungkin, gaya elektrostatik total dapat dikaitkan dengan gaya elektrostatik muatan unit pada jarak tetangga terdekat dengan konstanta perkalian yang disebut konstanta Madelung yang dapat dihitung secara efisien dengan menggunakan penjumlahan Ewald.
Bila bentuk yang wajar diasumsikan untuk energi repulsif tambahan, energi kisi total dapat dimodelkan dengan menggunakan persamaan Born–Landé, persamaan Born–Mayer, atau tanpa adanya informasi struktural, persamaan Kapustinskii.
Dengan menggunakan aproksimasi yang lebih sederhana dari ion sebagai sferis keras yang tak tertembus, susunan anion dalam sistem ini sering dikaitkan dengan pengaturan sferis tetal-rapat (close-packed), dengan kation yang menempati interstisi tetrahedral atau oktahedral. Bergantung pada stoikiometri senyawa ionik, dan koordinasi (terutama ditentukan oleh rasio jari-jari) kation dan anion, sering diamati berbagai struktur, dan secara teoretis dirasionalisasi oleh aturan Pauling.
Struktur senyawa ionik umum dengan anion tetal-rapat
| Stoikiometri | Koordinasi kation:anion | Titik interstisi | Tetal rapat kubus anion | Tetal rapat heksagonal anion | |||
|---|---|---|---|---|---|---|---|
| penempatan | rasio jari-jari kritis | nama | konstanta Madelung | nama | konstanta Madelung | ||
| MX | 6:6 | semua oktahedral | 0,4142 | natrium klorida | 1,747565[37] | nikelin | <1,73[a][38] |
| 4:4 | selang-seling tetrahedral | 0.2247 | zinkblende | 1,6381[37] | wurtzit | 1,641[5] | |
| MX2 | 8:4 | semua tetrahedral | 0,2247 | fluorit | 5,03878[40] | ||
| 6:3 | setengah oktahedral (lapisan berseling terisi penuh) | 0,4142 | kadmium klorida | 5,61[41] | kadmium iodida | 4,71[40] | |
| MX3 | 6:2 | sepertiga oktahedral | 0,4142 | rodium(III) bromida | 6,67[44][c] | bismut iodida | 8,26[44][d] |
| M2X3 | 6:4 | dua pertiga oktahedral | 0,4142 | korundum | 25,0312[40] | ||
| ABO3 | dua pertiga oktahedral | 0,4142 | ilmenit | tergantung pada muatan dan struktur [e] | |||
| AB2O4 | seperdelapan tetrahedral dan satu setengah oktahedral | rA/rO = 0,2247; rB/rO = 0,4142 | spinel, spinel terbalik | tergantung pada distribusi situs kation[47][48][49] | olivin | tergantung pada distribusi situs kation[50] | |
Dalam beberapa kasus anion mengambil tetal kubus sederhana, dan struktur umum yang dihasilkan teramati adalah:
| Stoikiometri | Koordinasi kation:anion | Pengisian titik interstisi | Contoh struktur | ||
|---|---|---|---|---|---|
| nama | rasio jari-jari kritis | konstanta Madelung | |||
| MX | 8:8 | seluruhnya terisi | sesium klorida | 0,7321 | 1,762675 |
| MX2 | 8:4 | setengah terisi | kalsium fluorida | ||
| M2X | 4:8 | setengah terisi | litium oksida | ||
Beberapa cairan ionik, terutama dengan campuran anion atau kation, dapat didinginkan dengan cukup cepat sehingga tidak cukup waktu terjadi nukleasi kristal, maka terbentuklah kaca ionik (tanpa urutan jarak jauh).
Cacat
Dalam kristal ionik, biasanya akan ada beberapa titik cacat, tetapi untuk mempertahankan elektronetralitas, cacat ini hadir berpasangan. Cacat Frenkel terdiri dari kekosongan kation yang dipasangkan dengan interstisi kation dan dapat dihasilkan di manapun dalam ruah kristal, terjadi paling umum pada senyawa dengan bilangan koordinasi rendah dan kation yang jauh lebih kecil daripada anion.
Cacat Schottky terdiri dari satu kekosongan masing-masing jenis, dan dihasilkan pada permukaan kristal, terjadi paling umum pada senyawa dengan bilangan koordinasi tinggi dan bila anion dan kation memiliki ukuran yang sama.
Jika kation memiliki beberapa kemungkinan tingkat oksidasi, maka memungkinkan terjadi kekosongan kation untuk mengkompensasi kekurangan elektron pada lokasi kation dengan bilangan oksidasi lebih tinggi, menghasilkan senyawa non-stoikiometri. Kemungkinan non-stoikiometri lainnya adalah pembentukan pusat-F, elektron bebas yang menempati kekosongan anion.
Bila senyawa memiliki 3 atau lebih komponen ionik, semakin banyak jenis cacat yang mungkin terjadi. Semua titik cacat ini dapat dihasilkan melalui vibrasi termal dan memiliki konsentrasi kesetimbangan. Oleh karena mereka boros energi, tetapi bermanfaat secara entropis, mereka terjadi dalam konsentrasi yang lebih besar pada suhu yang lebih tinggi. Setelah terbentuk, pasangan cacat ini dapat berdifusi secara terpisah satu sama lain, dengan melompat antar situs kisi. Mobilitas cacat ini adalah sumber fenomena transportasi paling banyak dalam kristal ionik, termasuk difusi dan konduktivitas ionik benda padat.
Ketika kekosongan bertabrakan dengan interstisi (Frenkel), mereka dapat bergabung kembali dan saling memusnahkan. Demikian pula kekosongan akan hilang saat mereka mencapai permukaan kristal (Schottky). Cacat pada struktur kristal umumnya memperluas parameter kisi, mengurangi keseluruhan densitas kristal.
Cacat juga menghasilkan ion di lingkungan lokal yang berbeda, yang menyebabkan mereka mengalami simetri medan kristal yang berbeda, terutama dalam kasus kation berbeda yang bertukar situs kisi.
Hal ini menghasilkan pemisahan orbital elektron-d yang berbeda, sehingga penyerapan optik (dan tentu saja warna) dapat berubah seiring dengan konsentrasi defek.
Sifat-Sifat Senyawa Ionik
Keasaman / Alkalinitas
Senyawa ionik yang mengandung ion hidrogen (H+) diklasifikasikan sebagai asam, dan yang mengandung kation elektropositif dan anion basa ion hidroksida (OH−) atau ion oksida (O2−) diklasifikasikan sebagai basa. Senyawa ion lainnya dikenal sebagai garam dan dapat terbentuk melalui reaksi asam–basa.
Jika senyawa tersebut merupakan hasil reaksi antara asam kuat dan basa lemah, hasilnya adalah garam asam. Reaksi antara basa kuat dan asam lemah, menghasilkan garam basa. Hasil reaksi antara asam kuat dan basa kuat, menghasilkan garam netral. Asam lemah yang direaksikan dengan basa lemah dapat menghasilkan senyawa ionik dengan ion basa konjugat maupun ion asam konjugat, seperti amonium asetat.
Beberapa ion dikelompokkan sebagai amfoter, mampu bereaksi dengan asam atau basa. Hal ini juga berlaku untuk beberapa senyawa dengan sifat ionik, biasanya oksida atau hidroksida dari logam-logam yang kurang elektropositif (sehingga senyawa tersebut juga memiliki sifat kovalen yang signifikan), seperti seng oksida, aluminium hidroksida, aluminium oksida dan timbal(II) oksida.
Titik lebur dan titik didih
Gaya elektrostatik antar partikel adalah yang terkuat saat muatannya tinggi, dan jarak antar inti ion kecil. Dalam kasus tersebut, senyawa umumnya memiliki titik leleh dan titik didih yang sangat tinggi dan tekanan uap rendah. Tren titik lebur bisa dijelaskan dengan lebih baik bila struktur dan rasio ukuran ion diperhitungkan. Di atas titik leburnya, padatan ionik meleleh dan menjadi garam cair (walaupun beberapa senyawa ionik seperti aluminium klorida dan besi(III) klorida menunjukkan struktur seperti molekul dalam fase cairnya).
Senyawa anorganik dengan ion sederhana biasanya memiliki ion kecil, dan dengan demikian memiliki titik lebur yang tinggi, begitu juga padatannya pada suhu kamar. Bagaimanapun, beberapa zat dengan ion yang lebih besar, memiliki titik leleh di bawah atau mendekati suhu kamar (sering didefinisikan sampai dengan 100 °C), dan disebut cairan ionik. Ion dalam cairan ionik seringkali memiliki distribusi muatan yang tidak rata, atau substituen besar seperti rantai hidrokarbon, yang juga berperan dalam menentukan kekuatan interaksi dan kecenderungan untuk meleleh.
Bahkan ketika struktur lokal dan ikatan padatan ionik cukup terganggu untuk melelehkannya, masih ada gaya tarik elektrostatik jarak jauh yang kuat yang menahan cairan bersama-sama dan mencegah ion mendidih untuk membentuk fasa gas. Ini berarti bahwa cairan ionik suhu kamar sekalipun memiliki tekanan uap rendah, dan memerlukan suhu yang jauh lebih tinggi untuk mendidih. Titik didih menunjukkan kecenderungan serupa pada titik leleh dalam hal ukuran ion dan kekuatan interaksi lainnya. Bila diupkan, ionnya masih belum terbebaskan satu sama lain. Misalnya, dalam fase uap natrium klorida berada sebagai “molekul” diatomik.
Kerapuhan
Sebagian besar senyawa ionik sangat rapuh. Begitu mereka mencapai batas kekuatan mereka, mereka tidak dapat diubah bentuknya dengan jalan ditempa, karena keselarasan ion positif dan negatif harus dijaga ketat. Sebaliknya material mengalami fraktur melalui pembelahan. Ketika suhu dinaikkan (biasanya mendekati titik leleh) terjadi transisi lentur–rapuh, dan aliran plastik menjadi dimungkinkan oleh gerak dislokasi.
Kompresibilitas
Kompresibilitas senyawa ion sangat ditentukan oleh strukturnya, dan khususnya bilangan koordinasinya. Misalnya, halida dengan struktur cesium klorida (bilangan koordinasi 8) kurang termampatkan dibandingkan dengan struktur natrium klorida (bilangan koordinasi 6), dan kurang lagi dibandingkan dengan bilangan koordinasi 4.
Kelarutan
Bila senyawa ion larut, ion individu terdisosiasi dan tersolvasi dengan pelarut dan terdispersi di seluruh larutan yang dihasilkan. Karena ion dilepaskan ke dalam larutan saat dilarutkan, dan dapat membawa muatan, senyawa ion terlarut adalah kelas elektrolit kuat yang paling umum, dan larutannya memiliki konduktivitas listrik tinggi.
Kelarutan paling tinggi adalah dalam pelarut polar (seperti air) atau cairan ionik, tetapi cenderung rendah pada pelarut nonpolar (seperti bensin). Hal ini terutama karena interaksi ion–dipol yang dihasilkan secara signifikan lebih kuat daripada interaksi dipol yang diinduksi ion, sehingga panas larutan lebih tinggi. Ketika ion-ion yang bermuatan berlawanan pada kisi ionik padat dikelilingi oleh kutub yang berlawanan dari molekul polar, ion-ion padat dikeluarkan dari kisi dan masuk ke dalam cairan. Jika energi solvasi melebihi energi kisi, perubahan entalpi bersih negatif dari larutan memberikan dorongan termodinamika untuk menghilangkan ion dari posisi mereka di dalam kristal dan larut dalam cairan. Selain itu, perubahan entropi larutan biasanya positif untuk zat terlarut padat seperti senyawa ionik, yang berarti kelarutannya meningkat saat suhu meningkat.
Ada beberapa senyawa ionik yang tidak biasa seperti serium(III) sulfat, dimana perubahan entropi ini negatif, karena adanya pengurutan ekstra yang diinduksi dalam air terhadap larutan, dan kelarutannya berkurang seiring dengan suhu.
Konduktivitas listrik
Meskipun senyawa ionik mengandung atom atau cluster bermuatan, bahan ini biasanya tidak mengalirkan listrik sampai batas tertentu dalam bentuk padatannya. Agar dapat menghantarkan listrik, partikel bermuatan harus dalam kondisi bergerak dan tidak hanya diam dalam kisi kristal. Hal ini dapat dicapai sampai tingkat tertentu pada suhu tinggi ketika konsentrasi cacat meningkatkan mobilitas ionik dan konduktivitas ionik benda padat teramati. Ketika senyawa ionik tersebut dilarutkan dalam cairan atau dilebur menjadi cairan, mereka dapat menghantarkan listrik karena ionnya benar-benar bergerak. Konduktivitas yang diperoleh pada saat dilarutkan atau dilelehkan ini kadang-kadang digunakan untuk mendefinisikan karakteristik senyawa ionik.
Pada beberapa senyawa ionik yang tidak umum: konduktor ion cepat, dan kaca ionik, satu atau lebih komponen ioniknya memiliki mobilitas yang signifikan, sehingga memungkinkan konduktivitas meskipun material tetap dalam kondisi padat. Hal ini sering tergantung suhu, dan mungkin merupakan hasil dari perubahan fase atau konsentrasi defek yang tinggi. Bahan-bahan ini digunakan di semua superkapasitor benda padat, baterai, dan sel bahan bakar, dan dalam berbagai jenis sensor kimia.
Warna
Warna senyawa ionik seringkali berbeda dengan warna larutan berair yang mengandung ion penyusunnya, atau dengan bentuk hidratnya dari senyawa yang sama.
Anion dalam senyawa dengan ikatan dengan karakter paling ionik cenderung tidak berwarna (dengan pita absorpsi di bagian spektrum ultraviolet). Dalam senyawa dengan karakter kurang ionik, warna mereka semakin tajam melalui kuning, oranye, merah dan hitam (karena pita serapan bergeser ke panjang gelombang yang lebih panjang ke dalam spektrum sinar tampak).
Pita absorpsi kation sederhana bergeser ke arah panjang gelombang yang lebih pendek saat mereka lebih banyak terlibat dalam interaksi kovalen. Hal ini terjadi selama hidrasi ion logam, sehingga senyawa ionik anhidrat yang tidak berwarna dengan anion yang menyerap inframerah dapat menjadi beraneka warna dalam larutannya.
Kegunaan Senyawa Ionik
Senyawa ionik telah lama memiliki beragam kegunaan dan aplikasi. Berikut contohnya:
- Banyak mineral bersifat ionik. Manusia telah mengolah garam biasa (natrium klorida) selama lebih dari 8000 tahun, awal mulanya digunakan sebagai bumbu makanan dan pengawet, dan sekarang juga merambah bidang manufaktur, pertanian, pengkondisian air, untuk awapengesan jalan, dan banyak kegunaan lainnya. Banyak senyawa ionik digunakan di masyarakat sehingga mereka menggunakan nama umum yang tidak terkait dengan identitas kimia mereka. Contohnya termasuk boraks, kalomel, susu magnesia, asam muriatat, minyak vitriol, sendawa, dan kapur mati.
- Senyawa ionik yang mudah larut seperti garam dapat dengan mudah dilarutkan untuk menghasilkan larutan elektrolit. Ini adalah cara sederhana untuk mengendalikan konsentrasi dan kekuatan ion. Konsentrasi zat terlarut mempengaruhi banyak sifat koligatif, termasuk meningkatkan tekanan osmotik, menurunkan titik beku dan menaikkan titik didih. Oleh karena zat terlarut adalah ion bermuatan, maka mereka juga meningkatkan konduktivitas listrik larutan. Kekuatan ion yang meningkat mengurangi ketebalan lapisan ganda listrik di sekitar partikel koloid, dan juga stabilitas emulsi dan suspensi.
- Identitas kimia dari ion yang ditambahkan juga penting dalam banyak kegunaan. Misalnya, senyawa yang mengandung fluorida dilarutkan untuk memasok ion fluorida pada fluoridasi air.
- Senyawa ion padat telah lama digunakan sebagai pigmen cat, dan tahan terhadap pelarut organik, tetapi peka terhadap keasaman atau kebasaan. Sejak 1801 piroteknisi telah menggambarkan dan banyak menggunakan senyawa ionik yang mengandung logam sebagai sumber warna dalam kembang api. Di bawah panas yang hebat, elektron dalam ion logam atau molekul kecil dapat tereksitasi. Elektron ini kemudian kembali ke keadaan berenergi lebih rendah, dan melepaskan cahaya dengan karakteristik spektrum warna dari spesies yang ada.
- Dalam kimia, senyawa ionik sering digunakan sebagai prekursor untuk sintesis zat padat suhu tinggi.
- Banyak logam yang secara geologis paling melimpah, mengandung senyawa ion dalam bijihnya. Untuk mendapatkan unsurnya, bijih ini diproses dengan peleburan atau elektrolisis, yang melibatkan reaksi redoks (seringkali dengan reduktor seperti karbon) sehingga ion logam mendapatkan elektron menjadi atom netral.
Tata nama
Menurut tata nama yang direkomendasikan oleh IUPAC, senyawa ionik dinamai sesuai komposisi mereka, bukan strukturnya. Dalam kasus yang paling sederhana dari senyawa ionik biner tanpa ambiguitas yang mungkin timbul berkenaan dengan muatan dan stoikiometrinya, nama umum ditulis menggunakan dua kata.
Nama kation (nama unsur yang tidak dimodifikasi untuk kation monatomik) muncul lebih dulu, diikuti dengan nama anion.
Sebagai contoh, MgCl2 diberi nama magnesium klorida, dan Na2SO4 diberi nama natrium sulfat (SO2−4, sulfat, adalah contoh ion poliatomik). Untuk mendapatkan rumus empiris dari nama-nama ini, stoikiometrinya dapat disimpulkan dari muatan ionnya, dan persyaratan netralitas muatan keseluruhan.
Jika ada beberapa kation dan/atau anion yang berbeda, awalan multiplikasi (di-, tri-, tetra-, …) sering diperlukan untuk menunjukkan komposisi relatif, dan kation kemudian anion dicantumkan dalam urutan sesuai abjad.
Sebagai contoh, KMgCl3 diberi nama kalium magnesium triklorida untuk membedakannya dari K2MgCl4, dikalium magnesium tetraklorida (perhatikan bahwa baik dalam rumus empiris dan nama tertulis, kation muncul dalam urutan abjad, tetapi urutannya bervariasi antara keduanya karena lambang untuk kalium adalah K).
Bila salah satu ion sudah memiliki awalan multiplikatif dalam namanya, digunakan awalan multiplikatif alternatif (bis-, tris-, tetrakis-, …).
Sebagai contoh, Ba(BrF4)2 diberi nama barium bis(tetrafluoridobromat).
Senyawa yang mengandung satu atau lebih unsur yang dapat berada dalam berbagai muatan/tingkat oksidasi akan memiliki stoikiometri yang bergantung pada keadaan oksidasi yang ada, untuk memastikan netralitas secara keseluruhan. Hal ini dapat ditunjukkan dalam nama dengan menentukan tingkat oksidasi dari unsur-unsur yang ada, atau muatan ionnya.
Karena risiko ambiguitas dalam mengalokasikan tingkat oksidasi, IUPAC lebih memilih indikasi langsung jumlah muatan ionik.[106] Ini ditulis sebagai bilangan bulat dalam angka arab diikuti oleh tanda (… , 2−, 1−, 1+, 2+, …) dalam tanda kurung secara langsung setelah nama kation (tanpa spasi yang memisahkannya).
Sebagai contoh, FeSO4 diberi nama besi(2+) sulfat (dengan muatan 2+ pada ion Fe2+ yang menyeimbangkan muatan 2− pada ion sulfat), sedangkan Fe2(SO4)3 dinamakan besi(3+) sulfat (karena dua ion besi di setiap unit formula masing-masing memiliki muatan 3+, untuk menyeimbangkan muatan 2− pada masing-masing tiga ion sulfat).
Tata nama Stock, masih umum digunakan, menulis bilangan oksidasi dalam angka Romawi (… , −II, −I, 0, I, II, …). Jadi contoh yang diberikan di atas masing-masing dinamakan besi(II) sulfat dan besi(III) sulfat.
Untuk ion sederhana muatan ion dan bilangan oksidasi identik, tetapi untuk ion poliatomik seringkali berbeda. Misalnya, ion uranil(2+), UO2+2, memiliki uranium dengan tingkat oksidasi +6, jadi akan disebut ion dioksouranium(VI) dalam tata nama Stok.
Sebuah sistem penamaan yang lebih tua untuk kation logam, juga masih banyak digunakan, menambahkan akhiran -o dan -i ke akar bahasa Latin dari nama tersebut, untuk memberi nama khusus untuk tingkat oksidasi rendah dan tinggi.
Misalnya, skema ini menggunakan “fero” dan “feri”, masing-masing untuk besi(II) dan besi(III), sehingga contoh yang diberikan di atas secara klasik dinamakan fero sulfat dan feri sulfat.

Contoh Soal dan Jawaban Senyawa Ionik
1. Ion berikut mengalami hidrolisis dalam air, kecuali…
A. Na+
B. CN–
C. CO32–
D. Al3+
E. S2–
Jawaban : A
Pembahasan :
Karena merupakan elektrolit kuat sehingga tidak terhidrolisis dalam air.
2. Pernyataan berikut benar tentang zat elektrolit, kecuali…..
A. dalam air terionisasi menjadi kation dan anion.
B. larutannya dapat menghantarkan listrik.
C. dapat berupa senyawa ion maupun kovalen polar.
D. hanya berasal dari senyawa ionik saja.
E. derajat ionisasi 0 < α < 1.
Jawab
Ciri-ciri Zat elektrolit:
- Dapat terionisasi (kation/anion)
- Larutannya dapat menghantarkan arus listrik
- Merupakan senyawa ion atau kovalen polar
- Memiliki derajat ionisasi 0 < a < 1
JAWABAN : D
3. Berikut ini adalah pasangan yang termasuk senyawa kovalen dan bersifat elektrolit adalah….
- KCl dan NH3
- H2SO4 dan HCl
- KOH dan NaCl
- KBr dan PCl5
- Ba(OH)2 dan CO2
Jawab
Ciri senyawa kovalen terbentuk dari unsur non logam dengan non logam. Senyawa kovalen yang bersifat elektrolit adalah senyawa kovalen polar.
A.KCl dan NH3: KCl adalah senyawa ion ; NH3 adalah senyawa kovalen polar
B. H2SO4 dan HCl: H2SO4 dan HCl adalah senyawa kovalen polar
C. KOH dan NaCl: KOH adalah senyawa ion ; NaCl adalah senyawa ion
D. KBr dan PCl5: KBr adalah senyawa ion ; PCl5 adalah senyawa kovalen non polar
E. Ba(OH)2 dan CO2: Ba(OH)2 adalah senyawa ion ; CO2 adalah senyawa kovalen non polar.
4. Tata Nama Senyawa. Berilah nama senyawa-senyawa berikut menurut aturan IUPAC
1.MgO = Magnesium Oksida
2.SCl6 = Sulfur Heksaklorida
3.CuSO4 = Cu2+ + SO42- ® Tembaga (II) Sulfat
4.K2MnO4 = Kalium Permanganat
5.N2O4 = Dinitrogen Tetraoksida
6.Cl2O5 = Diklorin Pentaoksida
7.SnCl2 = Sn2+ + 2Cl- ® Timah (II) Klorida
8.Na2NO2 = Natrium Nitrit
9.K2Cr2O7 = Kalium Dikromat
10.Fe2(SO4)3 = 2Fe3+ + 3SO42- ® Besi (III) Sulfat
11.Mg3(PO4)2 = Magnesium Fosfat
12.HgCl2 = Hg2+ + 2Cl- ® Raksa (II) Klorida
13.H2SO3 = Asam Sulfit
14.H3PO3 = Asam Fosfit
15.Pb(OH)3 = Pb2+ + 3OH- ® Timbal (II) Hidroksida
5. Setarakan persamaan reaksi berikut :
Al(s) + Pb(NO3)2(g) → Al(NO3)3(aq) + Pb(s)
FeCl3(aq) + H2S(g) → FeCl2 (aq) + HCl(aq) + S(s)
Jawab
- 2Al(s) + 3Pb(NO3)2(g) → 2Al(NO3)3(aq) + 3Pb(s)
- 2FeCl3(aq) + H2S(g) → 2FeCl2 (aq) + 2HCl(aq) + S(s)
6. Persamaan Reaksi. Setarakan persamaan reaksi berikut :
K2Cr2O7 (s) + HCl (aq) → KCl(aq) + CrCl3 (aq) + Cl2 (g) + H2O(l).
Br2 (aq) + OH- (aq) → BrO3- (aq) + Br- (aq) + H2O (l)
Jawab
- K2Cr2O7 (s) + 14HCl (aq) → 2KCl(aq) + 2CrCl3 (aq) + 3Cl2 (g) + 7H2O(l)
- 3Br2 (aq) + 6OH- (aq) → BrO3- (aq) + 5Br- (aq) + 3H2O (l)
7. Berilah nama senyawa-senyawa kimia di bawah ini!
NaBr
CuCl
FeCl2
NH3
H2S
N2O5
Na2SO3
HClO3
Cu(OH)2
C2H5COOH
Jawaban:
- NaBr = Natrium Bromida
- CuCl = Tembaga (I) Klorida
- CuCl2 = Tembaga (II) Klorida
- NH3 = Amonia
- H2S = Hidrogen Sulfida
- N2O5 = Dinitrogen Pentaoksida
- Na2SO3 = Natrium Sulfit
- HClO3 = Asam Klorat
- Cu(OH)2 = Tembaga (II) Hidroksida
- C2H5COOH = Asam Propanoat
8. Tuliskan nama senyawa-senyawa berikut!
KCl
NaCl
MgI2
MgO
Na2S
Jawaban:
- KCl = Kalium Klorida
- NaCl = Natrium Klorida
- MgI2 = Magnesium Iodida
- MgO = Magnesium Oksida
- Na2S = Natrium Sulfida
9. Tuliskan nama senyawa-senyawa berikut!
- NaClO
- KMnO4
- CaCO3
- KNO3
Jawaban:
- NaClO = Natrium Hipoklorit
- KMnO4 = Kalium Permanganat
- CaCO3 = Kalsium Karbonat
- KNO3 = Kalium Nitrat
10. Ion Al3+ dalam air terhidrasi membentuk ion kompleks [Al(H2O)6]3+(aq). Ion kompleks tersebut dapat menetralkan ion hidroksida menurut reaksi berikut.
[Al(H2O)6]3+ + OH– ⇌ [Al(H2O)5OH]2+ + H2O
[Al(H2O)5OH]2+ + OH– ⇌ [Al(H2O)4(OH)2]+ + H2O
[Al(H2O)4(OH)2]+ + OH– ⇌ Al(H2O)3(OH)3 + H2O
Manakah pernyataan yang benar dari fakta di atas?
(A) [Al(H2O)6]3+ bertindak sebagai basa Lewis
(B) [Al(H2O)4(OH)2]+ merupakan basa konjugasi dari Al(H2O)3(OH)3
(C) Pada semua reaksi tersebut H2O bersifat basa
(D) [Al(H2O)4(OH)2]+ bersifat amfiprotik
(E) Al(H2O)3(OH)3 merupakan asam konjugasi dari [Al(H2O)6]3+
Basa Lewis adalah zat yang mendonorkan pasangan elektron kepada zat lain untuk digunakan bersama dalam membentuk ikatan kovalen koordinasi.
Asam Lewis zat yang dapat menerima pasangan elektron dari zat lain.
Syarat sebagai basa Lewis harus mempunyai pasangan elektron bebas dan syarat sebagai asam Lewis harus mempunyai orbital kosong pada atom pusatnya.
Pada proses hidrasi air mendonorkan PEB kepada ion Al3+ sebanyak 6 molekul, jadi air di sini berperan sebagai basa Lewis, dan ion Al3+sebagai asam Lewis.
Dari pilihan yang tersedia dan fakta maka air dalam semua reaksi bersifat sebagai basa.
Jawaban yang tepat C.
11. Tuliskan nama asam dari rumus kimia senyawa-senyawa berikut!
- HBr
- H2SO4
- HNO3
- HCl
- H2CO3
Jawaban:
- HBr = Asam Bromida
- H2SO4 = Asam Sulfat
- HNO3 = Asam Nitrat
- HCl = Asam Klorida
- H2CO3 = Asam Klorat
12. Tuliskan rumus kimia senyawa-senyawa asam berikut!
- Asam Sulfat
- Asam Klorat
- Asam Oksalat
- Asam Fosfat
- Asam Perklorat
Jawaban:
- Asam Sulfat = H2SO4
- Asam Klorat = HClO3
- Asam Oksalat = C2H2O4
- Asam Fosfat = H3PO4
- Asam Perklorat = HClO4
13. Tuliskan nama basa dari rumus kimia senyawa-senyawa berikut!
- KOH
- Mg(OH)2
- Fe(OH)2
- Zn(OH)2
- NaOH
Jawaban:
- KOH = Kalium Hidroksida
- Mg(OH)2 = Magnesium Hidroksida
- Fe(OH)2 = Besi (II) Hidroksida
- Zn(OH)2 = Seng Hidroksida
- NaOH = Natrium Hidroksida
Jenis Senyawa : Asam, Basa, Ionik, Garam, Oksida dan Organik

Klik disini untuk mengetahui jenis-jenis senyawa lainnya.
Bacaan Lainnya
- Jenis Senyawa : Asam, Basa, Ionik, Garam, Oksida dan Organik
- Asam Basa pH – Rumus Kimia, Penjelasan, Contoh Soal dan Jawaban
- Asam Basa Konjugat – Konjugasi Asam Basa & Rumus, Konjugat, Contoh Soal dan Jawaban
- pH Derajat Keasaman, p[H], pOH – Rumus, Soal dan Jawaban
- Rumus Kimia Konsep Mol Dan Empiris Beserta Contoh Soal Dan Jawaban
- Surfaktan Senyawa Organik – Penjelasan, Contoh Soal dan Jawaban
- Nama Obat dan Untuk Penyakit Apa ? – Daftar Nama Obat Esensial diterbitkan oleh Organisasi Kesehatan Dunia (WHO)
- Fraksi Mol Kimia”Xi” – Rumus, Penjelasan, Contoh Soal dan Jawaban
- Bagaimana Laut Mati / Dead Sea Mendapatkan Namanya? Mengapa Anda Dapat Mengapung Di Laut Mati?
- 10 Kegiatan Yang Akan Membantu Otak Anda Menjadi Tetap Muda Dan Tajam
- Jaringan tumbuhan yang berfungsi mengangankut air, dari akar ke daun adalah?
- Penyakit Alzheimer – Apa yang Terjadi di Otak?
- Apa Yang Terjadi Pada Saat Otak Kita Membeku?
- Sifat (perilaku) dapat dirubah. Tetapi watak (karakter) tidak dapat. Setuju ???
- Cara Berciuman – Tips, Nasihat Dan Langkah Untuk Ciuman Pertama Yang Sempurna
- 7 Cara Untuk Menguji Apakah Dia, Adalah Teman Sejati Anda Atau Bukan BFF (Best Friend Forever)
- Kepalan Tangan Menandakan Karakter Anda – Kepalan nomer berapa yang Anda miliki?
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan sering terdengar jika Anda memasang applikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Sumber bacaan: Britannica, Science Direct, LibreTexts, Elementalmatter
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya | Business & Marketing