Sejarah Tabel Periodik
Berikut adalah sejarah tabel periodik dari zaman dahulu, tahun 1789 sampai 1945.
Tahun 330 SM
Sejumlah unsur fisika (seperti platina, timah dan seng) telah dikenal sejak zaman purba, karena mereka ditemukan dalam bentuk alaminya dan relatif mudah ditambang menggunakan peralatan primitif. Namun, gagasan bahwa terdapat sejumlah kecil unsur yang mana seluruhnya berasal dari sekitar 330 SM, ketika filusuf Yunani Aristoteles mengusulkan bahwa semua terbuat dari campuran satu atau lebih akar, suatu ide yang sebelumnya dilontarkan oleh filusuf Sisilia Empedocles. Empat akar, yang kemudian dinamakan unsur oleh Plato, adalah tanah, air, udara dan api. Sementara Aristoteles dan Plato memperkenalkan konsep unsur, ide-ide mereka tidak meningkatkan pemahaman kealamian materi.

Sejarah Tabel Periodik Tahun 1789
Antoine Lavoisier mempublikasikan daftar 33 unsur kimia pada tahun 1789. Ia mengelompokkannya menjadi gas, logam, nonlogam dan tanah. Kimiawan menghabiskan waktu satu abad mencari skema klasifikasi yang lebih memadai.
Tahun 1829
Pada tahun 1829, Johann Wolfgang Döbereiner mengamati bahwa banyak unsur yang dapat dikelompokkan ke dalam triad berdasarkan sifat-sifat kimianya. Litium, natrium, dan kalium, misalnya, dikelompokkan ke dalam satu triad sebagai logam lunak dan reaktif. Döbereiner juga mengamati bahwa, jika disusun berdasarkan berat atom, anggota kedua masing-masing triad memiiliki berat atom rata-rata anggota pertama dan ketiga. Ini kemudian dikenal sebagai Hukum Triad. Kimiawan Jerman Leopold Gmelin meneliti sistem ini, dan pada tahun 1843 mengidentifikasi sepuluh triad, tiga kelompok empat dan satu kelompok lima. Jean-Baptiste Dumas mempublikasikan penelitiannya pada tahun 1857 yang menjelaskan hubungan antara berbagai kelompok logam. Meskipun banyak kimiawan mencoba untuk mengidentifikasi hubungan antar kelompok kecil unsur, mereka belum berhasil membangun suatu skema yang dapat menampung semuanya.
Tahun 1858
Pada tahun 1858, kimiawan Jerman August Kekulé mengamati bahwa karbon seringkali menggandeng empat atom karbon lain. Metana, misalnya, mempunyai satu atom karbon dan empat atom hidrogen. Konsep ini kelak dikenal sebagai valensi; unsur yang berbeda berikatan dengan sejumlah atom yang berbeda.
Sejarah Tabel Periodik Tahun 1862
Pada tahun 1862, Alexandre-Emile Béguyer de Chancourtois, geolog Perancis, mempublikasikan bentuk awal tabel periodik, yang disebutnya telluric helix atau sekrup. Ia adalah orang pertama yang mencatat periodisitas unsur-unsur.
Dengan menyusun unsur dalam suatu spiral pada silinder menurut kenaikan berat atom, de Chancourtois menunjukkan bahwa unsur-unsur dengan kesamaan sifat terlihat muncul pada interval tertentu.
Diagramnya mencantumkan pula beberapa ion dan senyawa sebagai tambahan, selain unsur-unsur. Makalahnya juga lebih banyak menggunakan istilah-istilah geologi daripada kimia, dan tidak menampilkan gambar; alhasil penelitiannya tidak menarik banyak pihak hingga diteruskan oleh Dmitri Mendeleev.
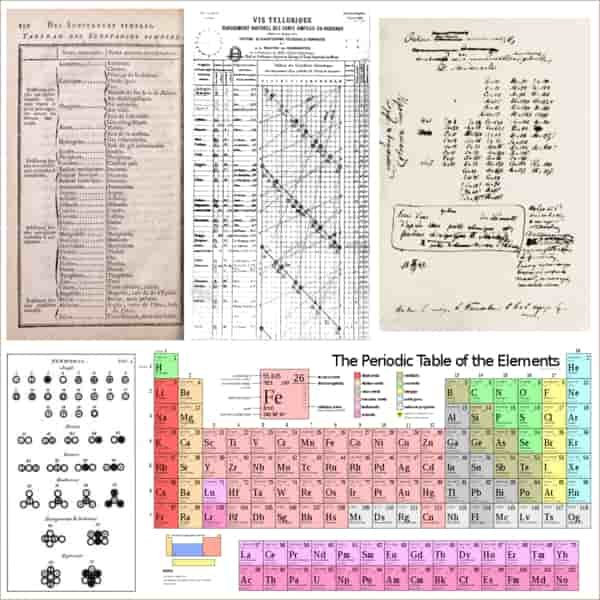
Tahun 1864
Pada tahun 1864, Julius Lothar Meyer, kimiawan Jerman, mempublikasikan tabel berisi 44 unsur yang disusun berdasarkan valensi. Tabel tersebut menunjukkan bahwa unsur-unsur dengan kesamaan sifat kimia seringkali memiliki valensi yang sama. Di tempat terpisah, William Odling (kimiawan Inggris) mempublikasikan suatu penyusunan 57 unsur, yang disusun berdasarkan berat atomnya.
Dengan beberapa ketakteraturan dan kesenjangan, ia melihat apa yang tampaknya menjadi periodisitas berat atom antara unsur-unsur dan bahwa ini sesuai dengan ‘pengelompokan yang sudah pernah diterima.’Odling menyinggung ide hukum periodik tapi ia tidak mengembangkannya. Ia kemudian mengusulkan (pada tahun 1870) klasifikasi unsur-unsur berbasis valensi.
Tahun 1924
Pada tahun 1914, setahun sebelum ia tewas dalam aksi di Gallipoli, fisikawan Inggris, Henry Moseley, menemukan hubungan antara panjang gelombang sinar-X unsur dengan nomor atomnya. Dia kemudian mampu mengurutkan ulang tabel periodik berdasarkan muatan inti, bukan berdasarkan berat atom. Sebelum penemuan ini, nomor atom diurutkan berdasarkan berat atom unsur.
Penemuan Moseley menunjukkan bahwa nomor atom sebenarnya didasarkan pada pengukuran eksperimental. Menggunakan informasi tentang panjang gelombang sinar-X, Moseley menempatkan argon (dengan nomor atom Z = 18) sebelum kalium (Z = 19), meskipun terdapat fakta bahwa berat atom argon 39,9 lebih besar daripada berat atom kalium (39,1).
Urutan baru itu sesuai dengan sifat kimia unsur-unsur, karena argon adalah gas mulia dan kalium merupakan logam alkali. Demikian pula, Moseley menempatkan kobalt sebelum nikel dan mampu menjelaskan bahwa telurium muncul sebelum iodium, tanpa merevisi berat atom eksperimental telurium, seperti yang telah diusulkan oleh Mendeleev.
Penelitian Moseley menunjukkan bahwa ada kekosongan dalam tabel periodik di nomor atom 43 dan 61, yang sekarang masing-masing ditempati oleh teknesium dan prometium.
Tahun 1943
Selama penelitian Manhattan Project pada tahun 1943, Glenn T. Seaborg mengalami kesulitan tak terduga dalam mengisolasi unsur amerisium dan curium. Seaborg bertanya-tanya apakah unsur-unsur ini milik deret yang berbeda, yang akan dapat menjelaskan mengapa sifat kimianya berbeda dari apa yang diharapkan.
Tahun 1945
Pada tahun 1945, menanggapi saran dari koleganya, ia mengusulkan perubahan signifikan terhadap tabel Mendeleev: Deret aktinida. Konsep aktinida Seaborg berdasarkan struktur elektronik unsur berat, dengan prediksi bahwa aktinida membentuk deret transisi yang analog dengan deret tanah jarang dalam deret lantanida, kini diterima dengan baik dan termasuk dalam tabel periodik. Deret aktinida adalah baris kedua dari blok-f (deret 5f).
Dalam kedua deret aktinida dan lantanida, ‘kulit elektron dalam’ sedang diisi. Deret aktinida terdiri dari unsur-unsur mulai aktinium hingga lawrensium. Elaborasi Seaborg selanjutnya tentang konsep aktinida berteori mengenai serangkaian unsur superberat dalam serangkaian transaktinida yang terdiri dari unsur-unsur mulai 104 hingga 121 serta serangkaian superaktinida mulai unsur 122 hingga 153.
Rumus Kimia Konsep Mol Dan Empiris Beserta Contoh Soal Dan Jawaban
Konsep Mol
Mol adalah satuan dasar SI (Satuan Internasional) yang mengukur jumlah zat.
Jika Anda telah mempelajari atom, molekul dan ion sebagai partikel-partikel materi. Bagaimana caranya menghitung jumlah yang sangat banyak dari partikel-partikel materi yang berukuran sangat kecil tersebut?
Untuk menyederhanakan jumlah partikel yang sangat kecil ini digunakan istilah MOL. Mol menyatakan satuan jumlah zat.
Bacaan Lainnya
- Manfaat Emas Dalam Pengobatan Kesehatan Medis
- Rumus Kimia Konsep Mol Dan Empiris Beserta Contoh Soal Dan Jawaban
- Manfaat Kalsium Untuk Tubuh Manusia
- Indonesia Juga Memiliki 3 Reaktor Nuklir
- Reaktor Nuklir Alami Zaman Purba
- Awalnya, reaktor nuklir pertama digunakan untuk produksi plutonium sebagai bahan senjata nuklir
- Top 10 Sungai Terpanjang Di Dunia
- Tes Kepribadian Warna & Warna Mana Yang Anda Miliki? Hijau, Oranye, Biru, Emas
- Kepalan Tangan Menandakan Karakter Anda & Kepalan nomer berapa yang Anda miliki?
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya | Business & Marketing
