Koefisien aktivitas
Koefisien aktivitas adalah suatu faktor yang digunakan dalam Termodinamika untuk memperhitungkan penyimpangan dari perilaku ideal dalam campuran zat kimia.
Konsep koefisien aktivitas terkait erat dengan aktivitas dalam kimia.
Definisi termodinamika
Potensial kimia, μB, dari suatu zat B dalam suatu campuran ideal cairan atau suatu larutan ideal dinyatakan oleh
di mana μoB adalah suatu potensial kimia dari suatu zat murni dan xB adalah fraksi mol zat dalam campuran.
Hal ini digeneralisasi untuk memasukkan perilaku non-ideal dengan menuliskan
di mana aB adalah aktivitas zat dalam campuran dengan
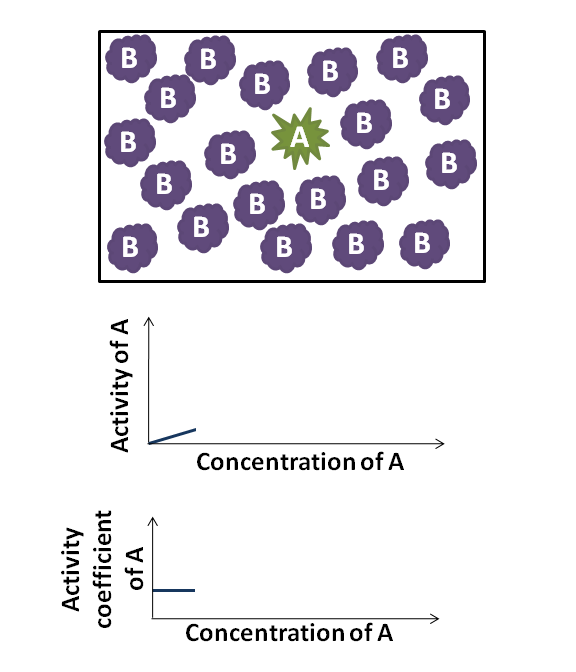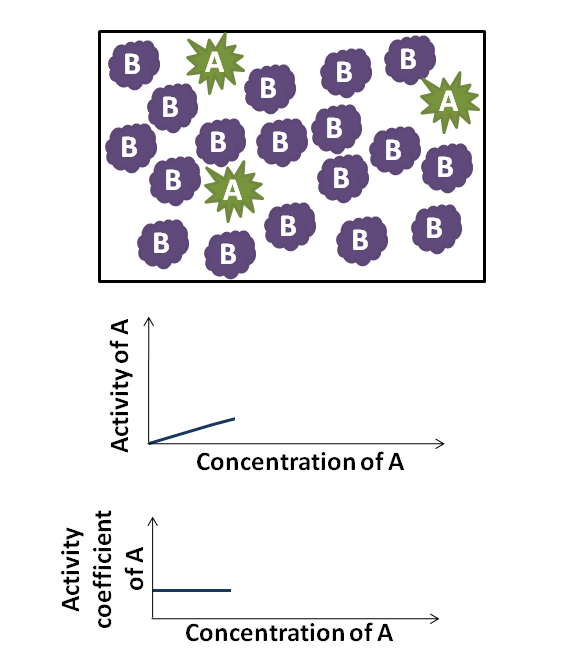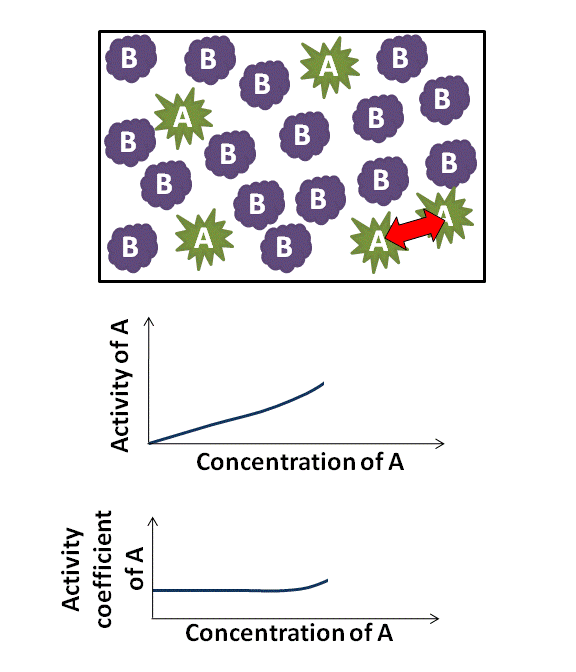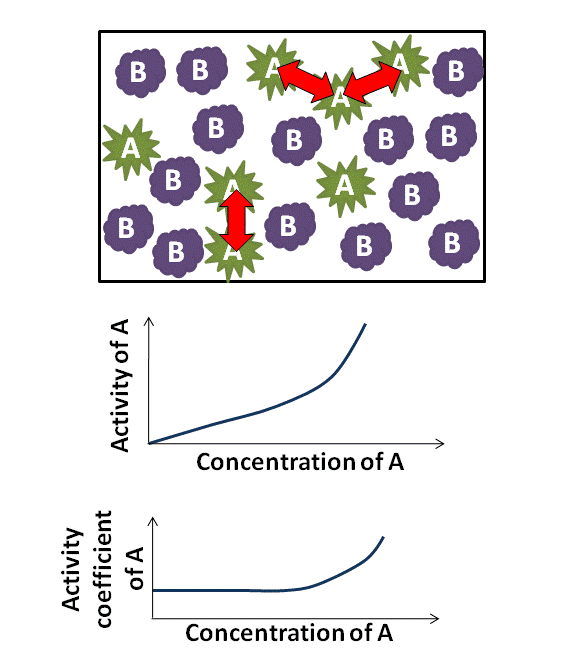
di mana γB adalah koefisien aktivitas, yang bergantung pada xB. Karena γB mendekati 1, zat tersebut berperilaku selayaknya ideal. Misalnya, jika γB ≈ 1, maka Hukum Raoult adalah akurat. Untuk γB > 1 dan γB < 1, zat B menunjukkan penyimpangan positif dan negatif dari Hukum Raoult, berturut-turut. Suatu penyimpangan positif menyiratkan bahwa zat B lebih mudah menguap.
Dalam banyak kasus, karena xB menuju ke nol, koefisien aktivitas zat B mendekati konstan; hubungan ini merupakan Hukum Henry bagi pelarut. Hubungan ini saling terkait satu sama lain melalui persamaan Gibbs–Duhem. Perlu dicatat bahwa koefisien aktivitas umum adalah tidak berdimensi.
Secara detail: Hukum Raoult menyatakan bahwa tekanan parsial komponen B terkait dengan tekanan uap (tekanan saturasi) dan fraksi molnya xB dalam fasa cair,
dengan konvensi Dengan kata lain: Cairan murni mewakili kasus ideal.
Pada pengenceran tak terbatas, koefisien aktivitas mendekati nilai batas, γB∞. Dibandingkan dengan hukum Henry,
memberikan
Dengan kata lain: Senyawa ini menunjukkan perilaku nonideal dalam kasus encer.
Definisi di atas dari koefisien aktivitas tidak praktis jika senyawa tidak ada sebagai cairan murni. Ini sering terjadi untuk elektrolit atau senyawa biokimia. Dalam kasus seperti itu, definisi yang berbeda digunakan yang menganggap pengenceran tak terbatas sebagai keadaan ideal:
dengan dan
Simbol telah digunakan di sini untuk membedakan antara dua jenis koefisien aktivitas. Biasanya dihilangkan, karena jelas dari konteks yang dimaksudkan.
Namun ada beberapa kasus di mana kedua jenis koefisien aktivitas diperlukan dan bahkan mungkin muncul dalam persamaan yang sama, misalnya, untuk larutan garam dalam campuran (air + alkohol). Ini terkadang merupakan sumber kesalahan.
Memodifikasi fraksi mol atau konsentrasi oleh koefisien aktivitas memberikan aktivitas efektif dari komponen, dan karenanya memungkinkan ekspresi seperti hukum Raoult dan konstanta kesetimbangan untuk diterapkan pada campuran ideal dan non-ideal.
Pengetahuan tentang koefisien aktivitas sangat penting dalam konteks elektrokimia karena perilaku larutan elektrolit sering jauh dari ideal, karena efek atmosfer ionik. Selain itu, mereka sangat penting dalam konteks kimia tanah karena volume rendah pelarut dan, akibatnya, konsentrasi elektrolit yang tinggi.
Dependensi pada parameter tetap – Turunan koefisien aktivitas
Turunan dari koefisien aktivitas sehubungan dengan suhu memiliki kaitan dengan entalpi molar berlebih oleh
Demikian pula, turunan dari koefisien aktivitas sehubungan dengan tekanan dapat dikaitkan dengan kelebihan volume molar.
Contoh Soal Koefisien Aktivitas
Hitunglah kekuatan ion dari larutan Na2SO4 0,01 M.
Penyelesaian:
Na2SO4 → 2Na+ + SO42–
[Na+] = 2 × [Na2SO4] = 0,02 M
[SO42–] = [Na2SO4] = 0,01 M
μ = ½ Σ ci × Zi2
μ = ½ {[Na+] × (+1)2 + [SO42–] × (-2)2}
μ = ½ {0,02 × (+1)2 + 0,01 × (-2)2}
μ = ½ {0,02 × 1 + 0,01 × 4}
μ = ½ {0,02 + 0,04}
μ = ½ 0,06
μ = 0,03 M
Hitunglah kekuatan ion dari larutan KCl 0,06 M.
Penyelesaian:
KCl → K+ + Cl–
[K+] = [KCl] = 0,06 M
[Cl–] = [KCl] = 0,06 M
μ = ½ Σ ci × Zi2
μ = ½ {[K+] × (+1)2 + [Cl–] × (-1)2}
μ = ½ {0,06 × (+1)2 + 0,06 × (-1)2}
μ = ½ {0,06 × 1 + 0,06 × 1}
μ = ½ {0,06 + 0,06 }
μ = ½ {0,12}
μ = 0,06 M
Bacaan Lainnya
- Entalpi Termokimia – Pemanasan / Kalor Fisika – Soal dan Jawaban
- Termokimia – Rumus, Penjelasan Beserta Contoh Soal dan Jawaban
- Tabel Periodik Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna dan Jenis
- Unsur, Senyawa dan Campuran Kimia – Beserta Penjelasan & Rumus
- Rumus Fisika: Alat optik: Lup, Mikroskop, Teropong Bintang, Energi, Frekuensi, Gaya, Gerak, Getaran, Kalor, Massa jenis, Medan magnet, Mekanika fluida, Momen Inersia, Panjang gelombang, Pemuaian, Percepatan (akselerasi), Radioaktif, Rangkaian listrik, Relativitas, Tekanan, Usaha Termodinamika, Vektor
- Bagaimana Albert Einstein mendapatkan rumus E=mc² ?
- Cara Mengemudi Aman Pada Saat Mudik atau Liburan Panjang
- Jenis Virus Komputer – Cara Gratis Mengatasi Dengan Windows Defender
- Cara Menghentikan Penindasan Bullying
- Cara menjaga keluarga Anda aman dari teroris – Ahli anti-teror menerbitkan panduan praktis
- Apakah Anda Memerlukan Asuransi Jiwa? – Cara Memilih Asuransi Jiwa Untuk Pembeli Yang Pintar
- 10 Cara Memotivasi Anak Untuk Belajar Agar Menjadi Pintar
- Daftar Jenis Kanker: Pemahaman Kanker, Mengenal Dasar-Dasar, Contoh Kanker, Bentuk, Klasifikasi, Sel dan Pemahaman Penyakit Kanker Lebih Jelas
- Penyebab Dan Cara Mengatasi Iritasi Atau Lecet Akibat Pembalut Wanita
- Sistem Reproduksi Manusia, Hewan dan Tumbuhan
- Cara Mengenal Karakter Orang Dari 5 Pertanyaan Berikut Ini
- Kepalan Tangan Menandakan Karakter Anda & Kepalan nomer berapa yang Anda miliki?
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan lebih sering terdengar jika Anda mengunduh aplikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Sumber bacaan: Libretexts
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya | Business & Marketing













