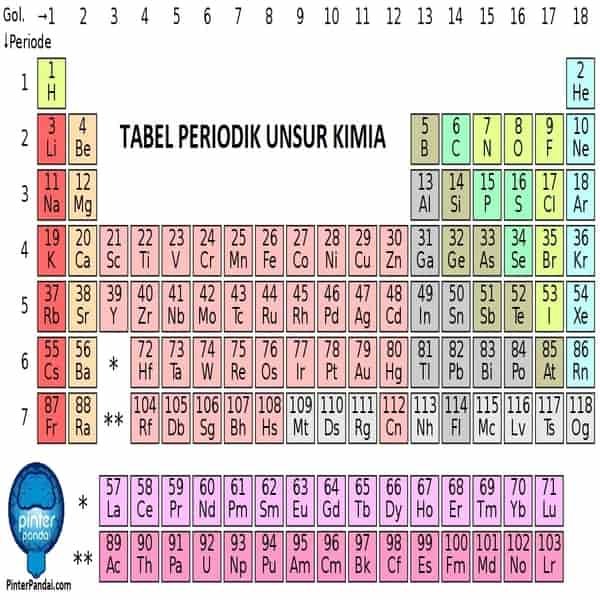
Blok Tabel Periodik
Blok tabel periodik adalah sekumpulan kelompok unsur kimia yang elektron valensinya menempati orbital yang memiliki bilangan kuantum azimut yang sama ℓ, yaitu milik lapisan subelektronik yang sama. Sebagai blok dalam tabel periodik, unsur-unsur kimia dikelompokkan menurut orbital atom paling energik dari kulit elektronnya. Sebuah blok menggabungkan beberapa kelompok tabel periodik.
Nama blok tabel periodik (s, p, d, f) berasal dari uraian garis spektroskopi orbital atom: (sharp, principal, diffuse, and fundamental) tajam, prinsip, difus, dan fundamental. Sampai saat ini tidak ada elemen blok-g yang diamati, tetapi huruf tersebut dipilih karena berada di urutan berikutnya menurut abjad setelah f.
Sublapisan ini ditandai dengan huruf s, p, d, f atau bahkan g, blok yang sesuai ditandai dengan huruf yang sama. Ada empat blok dalam tabel periodik standar, ditambah blok kelima yang muncul dari periode hipotetis ke-8:
blok s untuk ℓ = 0;
blok p untuk ℓ = 1;
blok d untuk ℓ = 2;
blok f untuk ℓ = 3;
blok g untuk ℓ = 4 dalam tabel periodik diperpanjang.
Istilah ini mungkin diperkenalkan pada tahun 1928 oleh Charles Janet.
Jika blok tabel periodik menutupi realitas fisik tertentu untuk periode pertama tabel periodik, konturnya menjadi jauh lebih kabur dari periode ke-6. Dengan demikian, batas antara blok d dan blok f tidak sesuai kesepakatan di antara ahli kimia: lantanum dan aktinium ditempatkan secara bergantian di salah satu blok dengan jumlah sumber yang kira-kira setara, yang juga mengarah pada penempatan lutetium dan lawrensium secara bergantian di salah satu blok juga.
Blok s
Blok s berada di tepi kiri tabel periodik dan termasuk semua unsur kimia dari golongan 1 dan golongan 2. Helium, yang terletak di kanan atas tabel, juga merupakan bagian dari balok s karena konfigurasi elektroniknya. , seperti hidrogen, hanya mengandung elektron dari subkulit s. Helium dengan demikian merupakan pengecualian dalam tabel periodik, karena ia termasuk dalam blok yang bukan dari kelompoknya, dalam hal ini kelompok 18.
Terlepas dari unsur periode ke-1, unsur-unsur blok s adalah logam yang sangat reaktif yang termasuk dalam keluarga logam alkali dan logam alkali tanah. Selama periode pertama, hidrogen adalah non-logam yang sangat reaktif, sedangkan helium adalah gas mulia yang inert secara kimiawi. Semua elemen ini dicirikan oleh fakta bahwa subkulit energi tertinggi dari elektron valensinya di keadaan dasar adalah tipe s, sesuai dengan bilangan kuantum azimut ℓ = 0.
Blok p
Semua unsur golongan utama lainnya termasuk dalam blok ini, yaitu logam tanah, golongan karbon, golongan nitrogen, kalkogen, halogen dan gas mulia.
Blok p terletak di tepi kanan tabel periodik dan mengandung unsur kimia dari golongan 13, 14, 15, 16, 17 dan 18, dengan pengecualian helium, yang termasuk dalam blok s.
Blok p mengandung keragaman elemen terbesar. Ini adalah satu-satunya yang mengandung unsur padat, cair (brom) dan gas dalam keadaan standar. Itu juga satu-satunya yang mengandung logam, metaloid dan non-logam. Semua elemen ini dicirikan oleh fakta bahwa subkulit energi tertinggi dari elektron valensinya di keadaan dasar adalah tipe p, sesuai dengan bilangan kuantum azimut ℓ = 1.
Blok d
Elektron-elektron ini tidak berada di kulit terluar, tetapi satu di bawah (lihat konfigurasi elektron, prinsip struktur). Karena unsur-unsur ini hanya memiliki satu atau (kebanyakan) dua elektron terluar masing-masing, mereka menunjukkan perilaku kimia yang serupa. Semua elemen subkelompok termasuk dalam blok ini.
Blok d terletak di tengah tabel periodik dan mengandung semua unsur kimia dari kelompok ke-3, ke-4, ke-5, ke-6, ke-7, ke-8, ke-9, ke-10, ke-11 dan ke-12 dari tabel tersebut.
Semua unsur blok d adalah logam dan semua golongan 4 sampai 11 adalah unsur transisi. Skandium dan yttrium dalam kelompok 3 dan copernicium dalam kelompok 12 juga, tetapi lutetium dan lawrensium dalam kelompok 3 adalah lantanida dan aktinida, sedangkan seng, kadmium dan merkuri dalam kelompok 12 termasuk jenis logam lain yang kadang-kadang disebut logam miskin atau post- logam transisi (istilah ini tidak banyak digunakan).
Semua elemen ini dicirikan oleh fakta bahwa subkulit energi tertinggi dari elektron valensinya dalam keadaan dasar harus, dengan penerapan aturan Klechkowski, berjenis d, sesuai dengan bilangan kuantum azimut ℓ = 2. Lawrensium adalah pengecualian di sini , karena konfigurasi elektronik keadaan dasarnya adalah [Rn] 7s2 5f14 7p1 dan oleh karena itu tidak mengandung elektron di subkulit iklan.
Blok f
Elektron-elektron ini juga tidak berada di kulit terluar, tetapi di kulit terluar ketiga. Oleh karena itu, kesamaan kimiawi di blok ini bahkan lebih jelas daripada di blok d. Blok-f termasuk lantanoid dan aktinida.
Blok f biasanya direpresentasikan di bawah tabel periodik dalam format 18 kolom atau di bagian tengah kiri tabel dalam format 32 kolom. Unsur-unsur yang menyusunnya tidak termasuk dalam salah satu dari 18 grup di tabel dan terletak di antara grup 2 dan grup 3.
Semua elemen blok f, selama periode ke-6, adalah lantanida dan, selama periode ke-7, aktinida. Ini kadang-kadang disebut logam transisi internal. Kimia lantanida sangat mirip dengan unsur-unsur Golongan 3, jadi keseluruhannya secara kolektif disebut tanah jarang.
Semua elemen ini dicirikan oleh fakta bahwa subkulit energi tertinggi dari elektron valensinya dalam keadaan dasar harus, dengan penerapan aturan Klechkowski, memiliki tipe f, sesuai dengan bilangan kuantum azimut ℓ = 3. Lantanum, aktinium, dan torium merupakan pengecualian, karena konfigurasi elektronnya pada keadaan dasar adalah [Xe] 6s2 5d1, [Rn] 7s2 6d1 dan [Rn] 7s2 6d2, dan oleh karena itu tidak mengandung elektron d ‘dalam subkulit f.
Blok g
Blok g bersifat hipotetis dan hanya disajikan dalam tabel periodik yang melampaui periode ke-7. Blok g adalah segmen superaktinoid.
Tabel Periodik Kimia – Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna Dan Jenis
Tabel periodik adalah tampilan unsur-unsur kimia dalam bentuk tabel. Unsur-unsur tersebut disusun berdasarkan nomor atom (jumlah proton dalam inti atom), konfigurasi elektron dan keberulangan sifat kimia. Klik disini untuk membaca tabel periodik yang komplit.
Sumber bacaan: Cleverly Smart
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya | Business & Marketing