Bilangan Oksidasi
Bilangan oksidasi ( biloks ) didefinisikan sebagai jumlah muatan negatif dan positif dalam atom, yang secara tidak langsung menandakan jumlah elektron yang telah diterima atau diserahkan. Atom yang menerima elektron akan bertanda negatif, atom yang melepaskan elektron bertanda positif. Dalam bahasa Inggris, bilangan oksidassi adalah oxidation state.
Tanda (+) dan (-) pada biloks ditulis sebelum angkanya, misalnya +2, atau +1; sedangkan pada muatan ditulis sesudah angkanya, misalnya 2+ atau 3+. Bilangan oksidasi menunjukkan besarnya muatan yang disumbangkan oleh atom atau unsur tersebut pada molekul atau ion yang dibentuknya.
Bilangan oksidasi juga berguna untuk mengekspresikan persamaan reaksi setengah yang terjadi dalam reaksi oksidasi dan reduksi.

Cara dan Aturan Penentuan Bilangan Oksidasi (Biloks)
Cara menentukan bilangan oksidasi suatu unsur dalam ion atau senyawanya mengikuti aturan-aturan sebagai berikut :
1. Bilangan oksidasi unsur bebas (berbentuk atom, atau molekul unsur) adalah 0 (nol).
Unsur bebas berbentuk atom.’
– Bilangan oksidasi C dalam C = 0
– Bilangan oksidasi Ca dalam Ca = 0
– Bilangan oksidasi Cu dalam Cu = 0
– Bilangan oksidasi Na dalam Na = 0
– Bilangan oksidasi Fe dalam Fe = 0
– Bilangan oksidasi Al dalam Al = 0
– Bilangan oksidasi Ne dalam Ne = 0
Unsur bebas berbentuk molekul.
– Bilangan oksidasi H dalam H2 = 0
– Bilangan oksidasi O dalam O2 = 0
– Bilangan oksidasi Cl dalam Cl2 = 0
– Bilangan oksidasi P dalam P4 = 0
– Bilangan oksidasi S dalam S8 = 0
2. Bilangan oksidasi logam dalam senyawa selalu positif.
Unsur logam golongan 1 (sistem lama gol. IA) (Li, Na, K, Rb, Cs, Fr), bilangan oksidasinya +1.
– Bilangan oksidasi K dalam KCl, KNO3, atau K2SO4 = +1
Unsur logam golongan 2 (sistem lama gol. IIA) (Be, Mg, Ca, Sr, Ba, Ra), bilangan oksidasinya +2.
– Bilangan oksidasi Mg dalam MgO, MgCl2, atau MgSO4 = +2
Bilangan oksidasi unsur logam lain:
– Ag = +1
– Cu = +1 dan +2
– Hg = +1 dan +2
– Au = +1 dan +3
– Fe = +2 dan +3
3. Bilangan oksidasi ion monoatom (1 atom) dan poliatom (lebih dari 1 atom) sama dengan muatan ionnya.’
Bilangan oksidasi ion monoatom Na+, Ca2+, Al3+, Cl–, dan 02- berturut-turut +1,+2, +3, -1 dan -2.
Bilangan oksidasi ion poliatom NH4+, SO42-, PO43- berturut-turut +1,-2, dan -3.
4. Bilangan oksidasi unsur golongan VIA (O, S, Se, Te, Po) pada senyawa biner adalah -2, dan unsur golongan VIIA (F, Cl, Br, I, At) pada senyawa biner adalah -1.’
Bilangan oksidasi unsur S pada Na2S dan MgS adalah -2.
Bilangan oksidasi unsur Cl pada NaCl, KCl, MgCl2, dan FeCl3 adalah -1.
5. Bilangan oksidasi unsur H pada senyawanya adalah +1.’
Kecuali dalam hidrida (senyawa hydrogen dengan logam), bilangan oksidasinya -1′
Alasan: dalam senyawa hidrida, hidrogen ada dalam bentuk ion hidrida, H–. Biloks dari ion seperti hidrida adalah sama dengan muatan ion, dalam hal ini adalah -1.’
Bilangan oksidasi unsur H pada H2O, HCl, H2S, dan NH3 adalah +1.
Bilangan oksidasi unsur H pada NaH, CaH2, dan AlH3 adalah -1.
6. Bilangan oksidasi unsur O pada senyawanya adalah -2, kecuali :’
1. Pada senyawa biner dengan F, bilangan oksidasinya adalah +2.
2. Pada senyawa peroksida, seperti H2O2, Na2O2 dan BaO2 , bilangan oksidasinya adalah -1.
3. Pada senyawa superoksida, seperti KO2 dan NaO2, bilangan oksidasinya adalah -½ . ‘
Bilangan oksidasi unsur O pada H2O, KOH, H2SO4 dan Na3PO4 adalah -2.
7. Jumlah bilangan oksidasi unsur-unsur dalam senyawa adalah 0 (nol). ‘
Jumlah bilangan oksidasi unsur-unsur pembentuk ion poliatom sama dengan muatan ion poliatomnya. ‘
Tabel Golongan Oksidasi
Golongan IA
H : 1
Li : 1
Na : 1
K : 1
Rb : 1
Cs : 1
Fr : 1
Golongan IIA
Be : 2
Mg : 2
Ca : 2
Sr : 2
Ba : 2
Ra : 2
Golongan IIIA
B : 3
Al : 3
Ga : 3
In : 3
Tl : 3, 1
Golongan IVA
C : 4, 2
Si : 4
Ge : 4
Sn : 4, 2
Pb : 4, 2
Golongan VA
N : 3, 5, 4, 2
P : 3, 5, 4
As : 3, 5
Sb : 3, 5
Bi : 3, 5
Golongan VI A
O : -2
S : 2, 4, 6
Se : -2, 4, 6
Te : -2, 4, 6
Po : 2, 4
Golongan VII A (Halogen)
F : -1
Cl : 1, 3, 5, 7
Br : 1, 3, 5, 7
I : 1, 5, 7
At : 1, 3, 5, 7
Golongan VIIIA (Gas mulia)
He : 1
Ne : 0
Ar : 0
Kr : 0
Xe : 0
Rn : 0
Golongan I B
Cu : 2, 1
Ag : 1
Au : 3, 1
Golongan II B
Zn : 2
Cd : 2
Hg : 2, 1
Golongan III B
Sc : 3
Y : 3
La : 3
Ac : 3
Golongan IV B
Ti : 4, 3
Zr : 4
Hf : 4
Golongan V B
V : 5, 4, 3, 2
Nb : 5, 3
Ta : 5
Golongan VI B
Cr : 6, 3, 2
Mo : 6, 5, 4, 3, 2
W : 6, 5, 4, 3, 2
Golongan VII B
Mn : 7, 6, 4, 3, 2
Tc : 7
Re : 7, 6, 4, 2, 1
Golongan VIII B
Fe : 2, 3
Ru : 2, 3, 4, 6, 8
Os : 2, 3, 4, 6, 8
Co : 2, 3
Rh : 2, 3, 4
Ir : 2, 3, 4, 6
Ni : 2, 3
Pd : 2, 4
Pt : 2, 4
Contoh soal dan Jawaban Biloks
1) Tentukan biloks atom unsur yaang dicetak tebal dalam senyawa berikut:
N2O5
MnO4–
Cr2O72-
Na2S2O7
Al2(SO4)3
Jawaban:
Bilangan yang oksidasi akan ditentukan, misalkan x.
1. Muatan N2O5 = (2 x biloks N) + (5 x biloks O)
0 = (2x (x)) + (5 x (-2))
0 = 2x – 10
x = +5
Jadi, biloks atom N dalam senyawa N2O5 = +5
2. Muatan MnO4– = (1 x biloks Mn) + (4 x biloks O)
-1 = (1 x (x)) + (4 x (-2))
-1 = x – 8
x = +7
Jadi, biloks atom Mn dalam senyawa MnO4– = +7
3. Muatan Cr2O72- = (2 x biloks Cr) + (7 x biloks O)
-2 = (2 x (x)) + (7 x (-2))
-2 = 2x -14
x = +6
Jadi, biloks atomCr dalam senyawa Cr2O72- = +6
4. Muatan Na2S2O7 = (2 x biloks Na) + (2 x biloks S) + (7 x biloks O)
0 = (2 x (+1)) + (2 x (x)) + (7 x (-2))
0 = 2 + 2x -14
x = +6
Jadi, biloks atom S dalam senyawa Na2S2O7 = +6
5. Muatan Al2(SO4)3 = (2 x biloks Al) + (3 x biloks S) + (12 x biloks O)
0 = (2 x (+3)) + (3 x (x)) + (12 x (-2))
0 = 6 + 3x -24
x = +6
Jadi, biloks atom S dalam senyawa Al2(SO4)3 = +6.
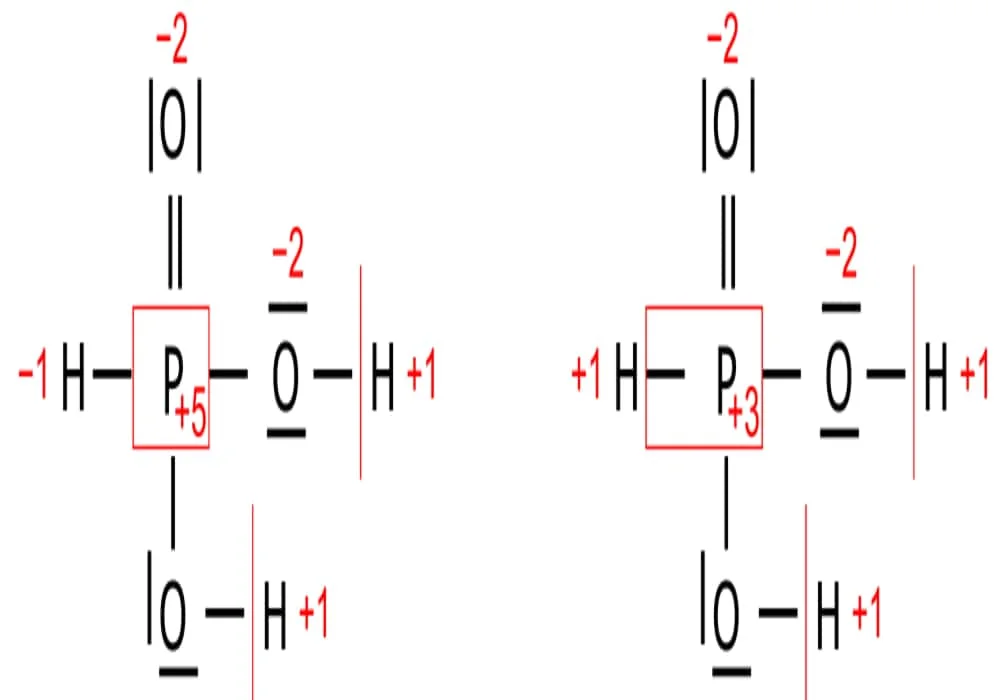
2) Tentukan BILOKS unsur yang digarisbawahi pada senyawa berikut.
- Fe2O3
- H2O2
- MnO4
Jawab:
1) Fe2O3
bilangan oksidasi O = –2 (aturan c)
2 biloks Fe + 3 biloks O = 0
2 biloks Fe + 3(–2) = 0
2 biloks Fe – 6 = 0
2 biloks Fe = +6
BiloksFe =+6/2
BiloksFe = +3
2) H2O2
biloks H = +1 (aturan b)
2 biloks H + 2 biloks O = 0
2(+1) + 2 biloks O = 0
+2 + 2 biloks O = 0
2 biloks O = –2
biloks O = –1
3) MnO4–
biloks O = –2 (aturan c)
biloks Mn + 4 biloks O = –1 (aturan h)
biloks Mn + 4(–2) = –1
biloks Mn – 8 = –1
biloks Mn = –1 + 8
biloks Mn = +7
3) Tentukan BILOKS N dalam ion NH4+!
4) Contoh Soal Menentukan Bilangan Oksidasi Atom dalam Senyawa Ion. Tentukan biloks setiap atom dalam senyawa dan ion berikut: NO2, ClO3– , NH4+.
5) Tentukan BILOKS S dalam SO2!
6) Menentukan BILOKS Atom dalam Senyawa Poliatom. Tentukan biloks atom-atom dalam Fe2(SO3)3.
7) Tentukan bilangan oksidasi Fe dalam Fe2O3!
8) Tentukan biloks N dalam NO2!
9) Tentukan biloks Mn adalam MnO4−!
10) Tentukan bilangan oksidasi S dalam SO3!
11) Tentukan biloks F dalam FeO!
12) Tentukan BILOKS Cl adalam ion ClO3−!
13) Tentukan bilangan oksidasi O dalam H2O2!
14) Tentukan biloks S dalam ion SO42–!
15) Tentukan biloks atom unsur dalam senyawa berikut ini:
N2O5
MnO4–
Cr2O72-
Na2S2O7
Al2(SO4)3
Jawab:
BILOKS akan ditentukan, misalkan x:
1. Muatan N2O5 ialah sama dengan (2 x biloks N) + (5 x biloks O)
0 = (2x (x)) + (5 x (-2))
0 = 2x – 10
x = +5
Maka, biloks atom N dalam senyawa N2O5 adalah +5
2. Muatan MnO4– ialah (1 x biloks Mn) + (4 x biloks O) ialah:
-1 adalah (1 x (x)) + (4 x (-2))
-1 adalah x – 8
x adalah +7
Maka, biloks atom Mn dalam senyawa MnO4– adalah +7
3. Muatan pada oksidasi Cr2O72- = (2 x biloks Cr) + (7 x biloks O) adalah:
-2 adalah (2 x (x)) + (7 x (-2))
-2 adalah 2x -14
x adalah +6
Maka, biloks atomCr dalam senyawa Cr2O72- adalah +6
4. Muatan pada unsur Na2S2O7 = (2 x biloks Na) + (2 x biloks S) + (7 x biloks O), ialah
0 = (2 x (+1)) + (2 x (x)) + (7 x (-2))
0 = 2 + 2x -14
x = +6
Maka, biloks atom S dalam senyawa Na2S2O7 adalah +6
5. Muatan pada Al2(SO4)3 = (2 x biloks Al) + (3 x biloks S) + (12 x biloks O), yaitu:
0 = (2 x (+3)) + (3 x (x)) + (12 x (-2))
0 = 6 + 3x -24
x = +6
Maka, biloks atom S dalam senyawa Al2(SO4)3 adalah +6.
Bacaan Lainnya
- Reduktor dan Oksidator – Penjelasan, Contoh Soal dan Jawaban
- Pembakaran Kimia – Persamaan Kimia – Sempurna & Tak Sempurna dan Contoh Soal beserta Jawabannya
- Tabel Periodik Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna dan Jenis
- Unsur, Senyawa dan Campuran Kimia – Beserta Penjelasan & Rumus
- Rumus Fisika: Alat optik: Lup, Mikroskop, Teropong Bintang, Energi, Frekuensi, Gaya, Gerak, Getaran, Kalor, Massa jenis, Medan magnet, Mekanika fluida, Momen Inersia, Panjang gelombang, Pemuaian, Percepatan (akselerasi), Radioaktif, Rangkaian listrik, Relativitas, Tekanan, Usaha Termodinamika, Vektor
- Bagaimana Albert Einstein mendapatkan rumus E=mc² ?
- Cara Menghentikan Penindasan Bullying
- Cara menjaga keluarga Anda aman dari teroris – Ahli anti-teror menerbitkan panduan praktis
- Apakah Anda Memerlukan Asuransi Jiwa? – Cara Memilih Asuransi Jiwa Untuk Pembeli Yang Pintar
- 10 Cara Memotivasi Anak Untuk Belajar Agar Menjadi Pintar
- Di Indonesia, (HAN) Hari Anak Nasional tanggal 23 Juli
- Ibu Hamil Dan Bahaya Kafein – Sayur & Buah Yang Baik Pada Masa Kehamilan
- Daftar Jenis Kanker: Pemahaman Kanker, Mengenal Dasar-Dasar, Contoh Kanker, Bentuk, Klasifikasi, Sel dan Pemahaman Penyakit Kanker Lebih Jelas
- Penyebab Dan Cara Mengatasi Iritasi Atau Lecet Akibat Pembalut Wanita
- Sistem Reproduksi Manusia, Hewan dan Tumbuhan
- Cara Mengenal Karakter Orang Dari 5 Pertanyaan Berikut Ini
- Kepalan Tangan Menandakan Karakter Anda & Kepalan nomer berapa yang Anda miliki?
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan lebih sering terdengar jika Anda mengunduh aplikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Sumber bacaan: Chemguide, University of Waterloo
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya | Business & Marketing
Terima kasih infonya sangat bermanfaat, ditunggu info menarik selanjutnya, jangan lupa kunjungi website kami juga di http://servismikroskop.com/
salam sukses selalu 🙂