Penjelasan Asam Basa Konjugat
Berikut adalah penjelasan asam basa konjugat: Dalam kimia, asam konjugat dan basa konjugat terbentuk dari reaksi asam-basa.
Asam konjugat terbentuk ketika suatu basa mendapatkan proton (H+), sementara basa konjugat terbentuk ketika suatu asam melepaskan proton. Ini berarti:
- Asam Konjugat: Hasil dari basa yang sudah mendapat proton.
- Basa Konjugat: Hasil dari asam yang sudah kehilangan proton.
Rumus Asam Konjugat
Asam konjugat dapat digambarkan dengan menggunakan reaksi kimia berikut:
- Asam + Basa
 Basa Konjugat + Asam Konjugat
Basa Konjugat + Asam Konjugat
Rumus Basa Konjugat
Basa konjugat dapat digambarkan dengan menggunakan reaksi kimia berikut:
Basa + H+ ⇄ Asam konjugasi
Belajar asam dan basa konjugat penting karena:
- Memahami reaksi kimia: konsep ini membantu memahami reaksi penting di tubuh dan lingkungan, seperti sistem buffer darah yang menjaga pH tetap stabil. Dalam tubuh, darah mengandung sistem buffer yang menjaga pH stabil dengan bantuan asam karbonat (H₂CO₃) dan ion bikarbonat (HCO₃⁻). Ketika pH darah turun, bikarbonat bertindak sebagai basa konjugat dan menyerap H⁺, membantu menormalkan pH.
- Aplikasi kesehatan: banyak obat bekerja berdasarkan reaksi asam-basa, seperti penetralan asam lambung. Obat antasida mengandung basa yang bekerja menetralkan asam lambung (HCl) yang berlebih. Dalam proses ini, HCl memberikan proton, dan basa konjugat terbentuk saat asam lambung netral.
- Industri & lingkungan: berguna di industri makanan, obat, dan pengelolaan pH tanah serta air. Reaksi asam-basa konjugat digunakan untuk mengontrol pH air dalam pengolahan limbah, membantu menjaga ekosistem dan mencegah korosi pipa.
- Dasar Penelitian: penting untuk riset dalam kimia, biologi, dan farmasi.
Konsep ini bermanfaat dalam kehidupan dan berbagai bidang pekerjaan.
Tabel Asam Basa Konjugat
| Asam | Basa konjugat |
|---|---|
| H2F+ Ion fluoronium | HF Asam fluorida |
| HCl Asam klorida | Cl− Ion klorida |
| H2SO4 Asam sulfat | HSO−4 Ion hidrogen sulfat |
| HNO3 Asam nitrat | NO−3 Ion nitrat |
| H3O+ Ion hidronium | H2O Air |
| HSO−4 Ion hidrogen sulfat | SO2−4 Ion sulfat |
| H3PO4 Asam fosfat | H2PO−4 Ion dihidrogen fosfat |
| CH3COOH Asam asetat | CH3COO− Ion asetat |
| H2CO3 Asam karbonat | HCO−3 Ion hidrogen karbonat |
| H2S Hidrogen sulfida | HS− Ion hidrosulfid |
| H2PO−4 Ion dihidrogen fosfat | HPO2−4 Ion hidrogen fosfat |
| NH+4 Ion amonium | NH3 Amonia |
| HCO−3 Ion hidrogen karbonat (bikarbonat) | CO2−3 Ion karbonat |
| HPO2−4 Ion hidrogen fosfat | PO3−4 Ion fosfat |
| H2O Air (netral, pH 7) | OH− Ion hidroksida |
Tabel Basa dan Asam Konjugat
| Basa | Asam konjugat |
|---|---|
| C2H5NH2 Etilamina | C2H5NH+3 Ion etilamonium |
| CH3NH2 Metilamina | CH3NH+3 Ion metilamonium |
| NH3 Amonia | NH+4 Ion amonium |
| C5H5N Piridina | C5H6N+ Piridinium |
| C6H5NH2 Anilina | C6H5NH+3 Ion fenilamonium |
| C6H5CO−2 Ion benzoat | C6H6CO2 Asam benzoat |
| F− Ion fluorida | HF Hidrogen fluorida |
Cara menemukan pasangan asam basa konjugasi
Pasangan asam-basa konjugat, atau konjugat asam dan basa, adalah dua senyawa yang saling berkaitan dalam reaksi asam-basa. Berikut cara mudah untuk menemukan pasangan asam-basa konjugat dalam reaksi kimia:
- Identifikasi reaktan: lihat senyawa pada sisi sebelum reaksi. Reaktannya adalah asam dan basa.
- Perhatikan hasil reaksi: asam dan basa menghasilkan pasangan konjugat di sisi sesudah reaksi.
- Tentukan asam konjugat: asam konjugat adalah hasil dari basa yang telah menerima ion hidrogen (H+). Jadi, cari senyawa di hasil reaksi yang memiliki tambahan H+.
- Tentukan basa konjugat: basa konjugat adalah hasil dari asam yang telah melepaskan H+. Senyawa yang kehilangan ion H+ di hasil reaksi adalah basanya.
Lihatlah contoh reaksi asam-basa berikut:
- HNO3 + H2O → H3O+ + NO−3
Asam nitrat (HNO3) adalah “asam” karena asam nitrat menyerahkan proton kepada molekul air, sementara “basa konjugat”nya adalah nitrat (NO−3). Molekul air menjadi basa karena mendapat proton hidrogen, sementara asam konjugatnya adalah ion hidronium (H3O+).
| Persamaan | Asam | Basa | Basa konjugat | Asam konjugat |
|---|---|---|---|---|
| HClO2 + H2O → ClO−2 + H3O+ | HClO2 | H2O | ClO−2 | H3O+ |
| ClO− + H2O → HClO + OH− | H2O | ClO− | OH− | HClO |
| HCl + H2PO−4 → Cl− + H3PO4 | HCl | H2PO−4 | Cl− | H3PO4 |
Contoh Pasangan Rumus Asam Basa Konjugasi
Contoh asam konjugasi
Contoh basa konjugasi

Reaksi Asam Basa
Dalam suatu reaksi asam-basa, asam dan basa membentuk basa konjugat dan asam konjugat:
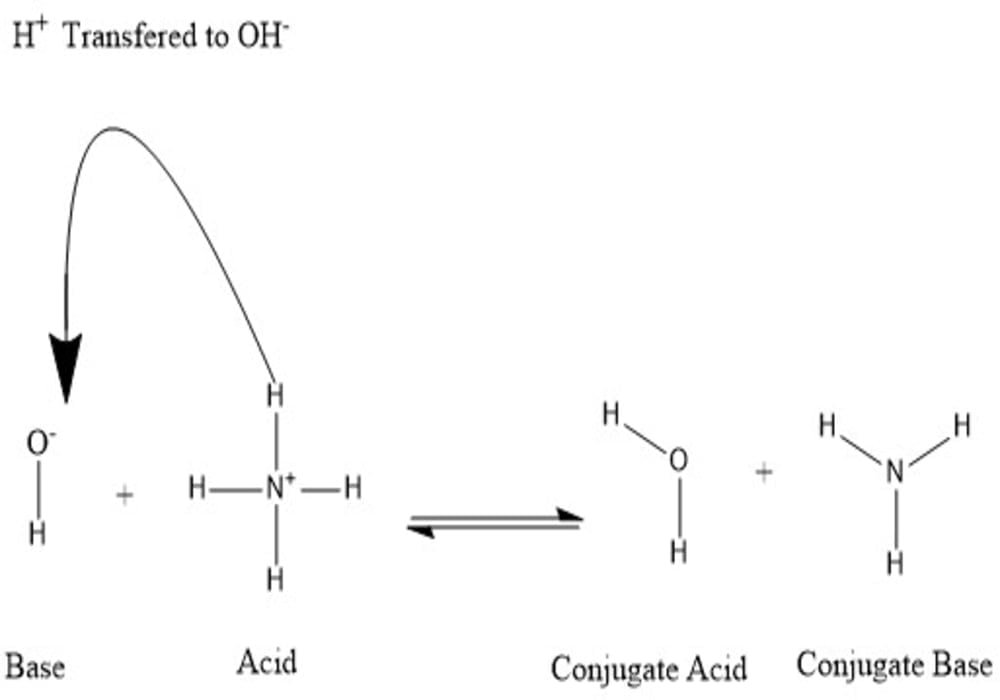
Konjugat terbentuk saat asam kehilangan proton hidrogen atau basa memperoleh proton hidrogen. Lihat gambar berikut:
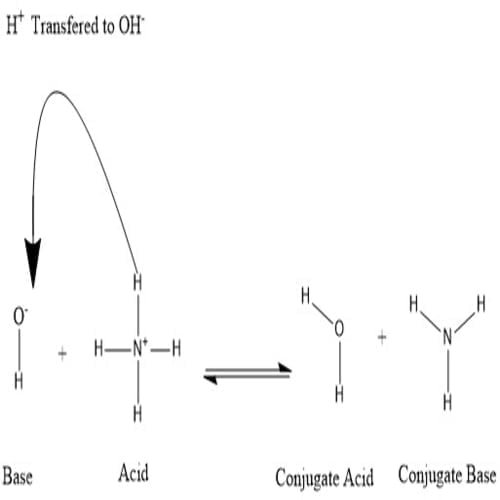
Dapat dikatakan bahwa molekul air adalah asam konjugat ion hidroksida setelah hidroksida mendapat proton hidrogen yang diberikan oleh amonium. Di sisi lain, amonia adalah basa konjugat untuk amonium asam setelah amonium telah menyerahkan ion hidrogen untuk menghasilkan molekul air. OH- dapat dianggap sebagai basa konjugat H2O, karena molekul air menyerahkan proton untuk menghasilkan NH+4 dalam reaksi ke arah sebaliknya, yang merupakan proses yang sangat sering terjadi di alam karena basa NH3 lebih kuat dari ion hidroksida. Berdasarkan informasi ini, dapat dilihat bahwa istilah “asam”, “basa”, “asam konjugat” dan “basa konjugat” bukanlah istilah yang berlaku tetap untuk suatu unsur kimia, tetapi dapat berganti-ganti tergantung pada situasinya.
? Baca selanjutnya: Reaksi Asam Basa – Rumus Kimia – Contoh Soal dan Jawaban

Contoh Soal dan Jawaban Asam Basa Konjugat
1. Tentukan rumus basa konjugasi dari NH4+
Jawaban:
Rumus cepatnya adalah
Basa Konjugasi : -1 H spesies
maka NH4+ itu basa konjugasinya menjadi NH3.
2. Berdasarkan reaksi berikut:
CH3OH(aq) + C2H3O2–(aq) ⇌ HC2H3O2(aq) + CH3O–(aq)
HC2H3O2(aq) + CO32–(aq) ⇌ HCO3– + C2H3O2–(aq)
C6H5NH3+(aq) + OH– (aq) ⇌ C6H5NH2(aq) + H2O(l)
Yang bukan pasangan asam-basa konjugasi adalah ….
(A) CH3OH dan CH3O–
(B) HC2H3O2dan HCO3–
(C) C6H5NH2 dan C6H5NH3+
(D) C2H3O2– dan HC2H3O2
(E) HCO3– dan CO32–
Jawaban:
Pasangan asam basa konjugasi cirinya adalah kemiripan rumus kimia dengan selisih jumlah H sebanyak satu atom H.
Yang bukan pasangan asam-basa konjugasi adalah HC2H3O2 dan HCO3–
Jawaban yang tepat B.
3. Carilah Persamaan Molekul, Persamaan Ion Lengkap dan Persamaan Ion Bersih jika Reaksi Antara Asam Klorida dengan Amnonia (HCI + NH3).
Jawaban:
Persamaan molekul: HCl(aq) + NH3(g) → NH4Cl(aq)
Persamaan ion lengkap: H+(aq) + Cl-(aq) + NH3(g) → NH4+(aq) + Cl-(aq)
Persamaan ion bersih: H+(aq) + NH3(g) → NH4+(aq)
4. Carilah Persamaan Molekul, Persamaan Ion Lengkap dan Persamaan Ion Bersih jika Reaksi Antara Asam Bromida dengan Natrium Oksida.
Jawaban:
Persamaan molekul: 2HBr(aq) + Na2O(s) → 2NaBr(aq) + H2O(l)
Persamaan ion lengkap: 2H+(aq) + 2Br-(aq) + Na2O(s) → 2Na+(aq) + 2Br-(aq) + H2O(l)
Persamaan ion bersih: 2H+(aq) + Na2O(s) → 2Na+(aq) + H2O(l)
Bacaan Lainnya
- Jenis Senyawa : Asam, Basa, Ionik, Garam, Oksida dan Organik
- Asam Basa pH – Rumus Kimia, Penjelasan, Contoh Soal dan Jawaban
- pH Derajat Keasaman, p[H], pOH – Rumus, Soal dan Jawaban
- Rumus Kimia Konsep Mol Dan Empiris Beserta Contoh Soal Dan Jawaban
- Contoh Soal Rumus Kimia Garam Dan Jawabannya
- Surfaktan Senyawa Organik – Penjelasan, Contoh Soal dan Jawaban
- Tabel Konstanta Fisika – Tabel konstanta universal, elektromagnetik, atom dan nuklir, fisika-kimia, nilai yang diadopsi, satuan natural, bilangan tetap
- Rumus Kimia Konsep Mol Dan Empiris Beserta Contoh Soal Dan Jawaban
- Surfaktan Senyawa Organik – Penjelasan, Contoh Soal dan Jawaban
- Nama Obat dan Untuk Penyakit Apa ? – Daftar Nama Obat Esensial diterbitkan oleh Organisasi Kesehatan Dunia (WHO)
- Fraksi Mol Kimia”Xi” – Rumus, Penjelasan, Contoh Soal dan Jawaban
- Ternyata, jatuh cinta sebabkan perubahan kimiawi pada otak – hormon serotonin
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan sering terdengar jika Anda memasang applikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Sumber bacaan: Britannica, Science Direct, LibreTexts, Elementalmatter